Введение
Плоскоклеточный рак кожи (ПКР) — один из самых часто встречающихся раков. Несмотря на увеличивающиеся знания и информирование населения о причинах рака кожи и мерах профилактики, частота заболеваемости ПКР растет по всему миру. Это имеет под собой множество причин: обсуждается общее старение населения, улучшенная диагностика, увеличение числа соляриев и факторов окружающей среды, например истончение озонового слоя.
Хотя при должной диагностике и своевременном лечении ПКР редко бывает смертельным, он может значительно усложнить жизнь, особенно при возникновении на лице. Большинство ПКР располагается на коже головы и шеи, поэтому обширное удаление при распространённом процессе может привести к неблагоприятным эстетическим результатам.
Диагностика ПКР начинается с подробного сбора анамнеза и физикального осмотра, и должна быть дополнена биопсией (в т.ч для исключения базалиомы и других поражений кожи).
Учитывая центральную роль ультрафиолетового (УФ) излучения в патогенезе ПКР, предотвращение воздействия УФ является основополагающим в профилактике ПКР. Кроме того лечение предраковых изменений кожи и самых ранних стадий является профилактикой будущего развития инвазивных опухолей.
Химиотерапия может рассматриваться, как адъювантное лечение при ПКР в случае высоких рисков рецидива и метастазирования. При ПКР с метастазами показана системная химиотерапия.
Этиология
Воздействие провоцирующих факторов и реакция на них со стороны организма определяют развитие ПКР. Хорошо известные факторы риска — УФ излучение, иммуносупрессия, воздействие ионизирующей радиации или химических канцерогенов, вирус папилломы человека.
Наиболее важный фактор риска развития ПКР — хроническое воздействие УФ, с которым можно столкнуться в соляриях, при медицинском лечении или получить в течение всей жизни. УФ излучение — хорошо известный мутаген, способный индуцировать повреждения ДНК, что приводит к трансформации кератиноцитов. УФ излучение также изменяет кожный иммунный ответ, делая кожу восприимчивой к образованию опухолей. УФВ (290-320нм) — это та часть спектра солнечного света, которая считается наиболее важной из-за инициации и промоции кожного канцерогенеза. На животных моделях УФ-индуцированный фотоканцерогенез вызывался УФВ и УФА-2. УФ-лечение, применяемое при псориазе (и ряде других стойких дерматозах) может служить предпосылкой для ПКР. Псорален и УФА (ПУВА) обладают фототоксичным эффектом и вызывают мутации в ТР53 и онкогене Ha-Ras, что наблюдается у значительной доли пациентов с ПУВА-ассоциированным ПКР. В дополнение к имеющейся мутагенности УФА в соединении с УФВ — сильный супрессор кожной иммунной системы, что вероятно также вносит вклад в кожный канцерогенез.
К особенностям организма, вносящим вклад в развитие ПКР, относят генетическую предрасположенность к повреждению ДНК и восприимчивость к повреждению УФ излучением. Хорошо известные признаки этого — светлый тип кожи и альбинизм. Люди со светлой кожей с карими, голубыми или серыми глазами и светлыми волосами (блондины и рыжие), а также те, кто с лёгкостью обгорают на солнце, имеют больший риск ПКР, чем люди с другими характеристиками. Большинство пациентов, у которых развивается ПКР, имеют 1 и 2 фототипы кожи. Среди пациенты с окулокутанным альбинизмом ПКР — одна из самых частых злокачественных опухолей. Причина кроется в природном отсутствии меланина, защиты от УФ-индуцированного канцерогенеза.
Генетические исследования Schwaerderle и соавт. выявили 7 генов (TP53, PIK3CA, CCND1, CDKN2A, SOX2, NOTCH1, FBXW7), которые чаще всего были повреждены при различных типах ПКР, в то время как ген KRAS повреждался при ПКР редко. Ряд кожных болезней, которые влияют или усугубляют развитие ПКР — пигментная ксеродерма, дистрофический буллезный эпидермолиз, верруциформная эпидермодисплазия, эрозивный красный плоский лишай. В ретроспективном исследовании Ahadiat и соавт. была предположена связь между гипотиреозом и развитием ПКР. Pedersen и соавт. показали, что гидрохлортиазид, один из самых часто назначаемых диуретиков и антигипертензивных препаратов в США и западной Европе, повышает риск базалиомы и ПКР. Гидрохлортиазид вызывает фотосенсибилизацию и на экспериментальной модели было показано, что он способствовал повреждению ДНК УФА. Исследовали сообщили о влиянии применения большого количества гидрохлортиазида (50г) — частота рисков базалиомы и ПКР соответственно составили 1,29 и 3,98. Частота рисков 1,54 и 7,38 была у пациентов с общей дозой 200г и выше.
Иммуносупрессия также признаётся фактором риска развития рака кожи; это верно как для ятрогенной, так и для неятрогенной иммуносупрессии (при трансплантации органов и у людей с ВИЧ). ПКР, развившийся на фоне иммуносупрессии, протекает более агрессивно, с высокой частотой рецидивов, метастазов и смертельных исходов.
Специфические механизмы, из-за которых иммуносупрессия ведет к развитию ПКР изучены плохо, но ослабленный иммунологический надзор считается важным условием возникновения опухоли. У пациентов с ПКР были выявлены CD8+ лимфоциты специфичные по отношению к супрессорному гену ТР53. На основании этого выдвинуто предположение, что функциональная иммунная система может быть нацелена на кератиноциты, экспрессирующие мутированный ТР53. Супрессия же иммунной системы предположительно аннулирует данный ответ способствуя развитию ПКР.
У пациентов после трансплантации при долгосрочном лечении, ПКР насчитывает 90% от всех видов раков. У таких пациентов ПКР возникает, чаще других новообразований из кератиноцитов, в т.ч. базалиом. Применение иммуносупрессантов для профилактики отторжения органов связано с 65-250-кратным риском развития ПКР по сравнению с общей популяцией. Более того, реципиенты имеют более высокий риск дальнейших ПКР с 66% вероятностью развития ПКР в течение 5 лет после первого диагноза ПКР. Уровень риска коррелирует с интенсивностью иммунносупрессии (от числа и дозы лекарств), обычно требуемой для профилактики отторжения. Для трансплантации сердца риск в 3 раза больше по сравнению с трансплантацией почки. Но в то время как у реципиентов с донорским сердцем риск развития опухолей больше, по сравнению реципиентами с донорской почкой, среднее число опухолей больше у последних. Это может быть обусловлено длительностью иммунносупрессии у пациентов с почкой, которые обычно моложе и живут в среднем дольше. Для пациентов с донорскими органами характерна не только частота возникновения опухолей, но и их агрессивное клиническое течение. В исследовании пациентов с донорскими сердцами и сердцами-легкими, у 4% пациентов развился агрессивный ПКР в течение 10 лет после трансплантации. Большинство опухолей (15 из 18) были низко дифференцированными, а ⅔ пациентов с агрессивными высыпаниями имели отдаленные метастазы или умерли от этих опухолей. Предшествующее трансплантации заболевание может также влиять на развитие ПКР после трансплантации. Например, среди пациентов с донорской почкой, высокая частота кожного рака наблюдалась у пациентов с поликистозной болезнью почек, в то время как низкая частота была у пациентов с диабетической нефропатией. Схожая ситуация у пациентов с холестатическими поражениями печени, риск у которых выше, чем у пациентов с печеночной недостаточностью.
Пациенты с ВИЧ-ассоциированной иммуносупрессией имеют умеренно повышенный риск развития немеланомного рака кожи (в 3-5 раза выше, чем в общей популяции). Но они имеют схожую частоту появления базалиомы и ПКР, характерную для пациентов с донорскими органами. Дефекты клеточно-опосредованного иммунитета, связанные с лимфопролиферативными заболеваниями (например, хроническая лимфоцитарная лейкемия), предрасполагает к развитию агрессивного ПКР.
Патофизиология
Злокачественное перерождение нормальных эпидермальных кератиноцитов — основа ПКР. Одно важнейших патогенетических событий — развитие устойчивости к апоптозу из-за функциональной недостаточности гена TP53, хорошо изученного гена опухолевой супрессии. Мутации TP53 наблюдаются более чем в 90% случаев рака в США, а также предполагается, что недостаточность функции TP53 во множестве предшествующих изменениях кожи является начальным событием ведущим к ПКР. УФ-излучение вызывает повреждение ДНК посредством создания пиримидиновых димеров, известный процесс приводящий к генной мутации ТР53. При последующем воздействии УФ-излучения кератиноциты подвергаются клональной экспансии, приобретают дальнейшие генетические дефекты, в конечном счете приводящим к инвазивному ПКР.
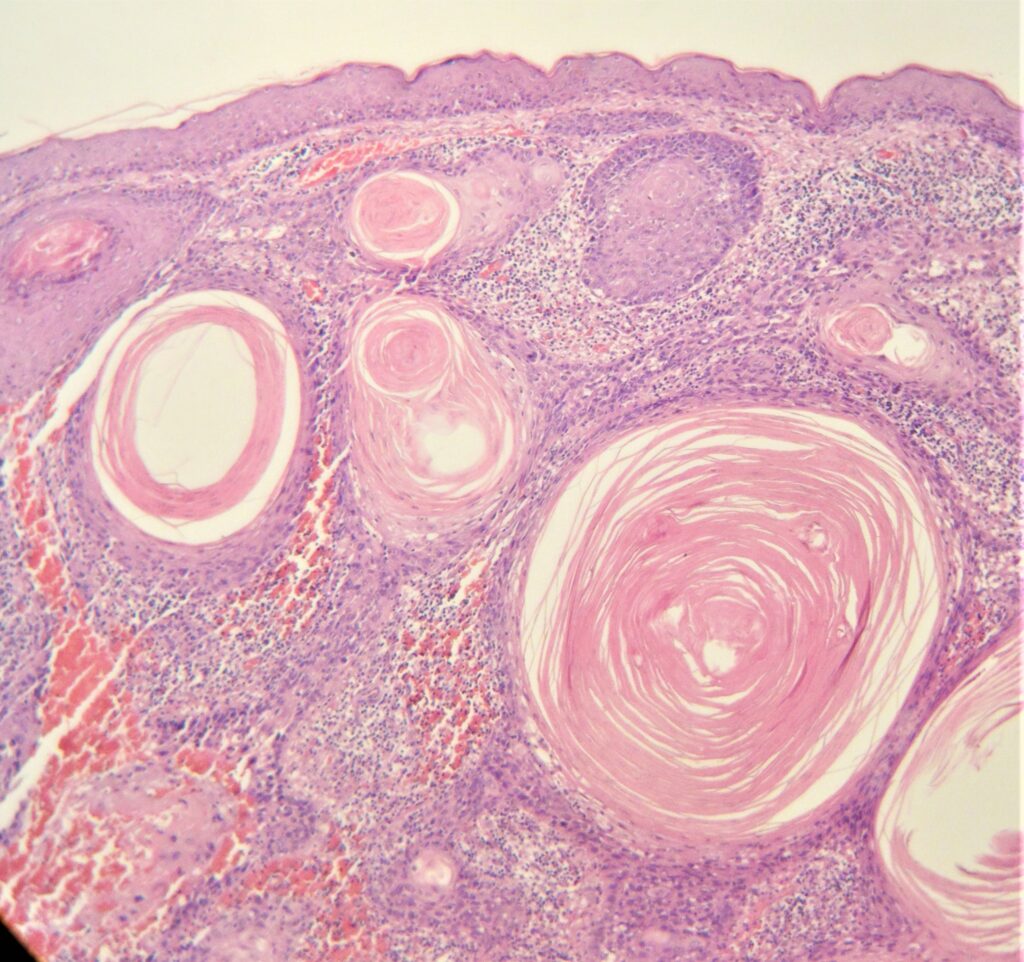
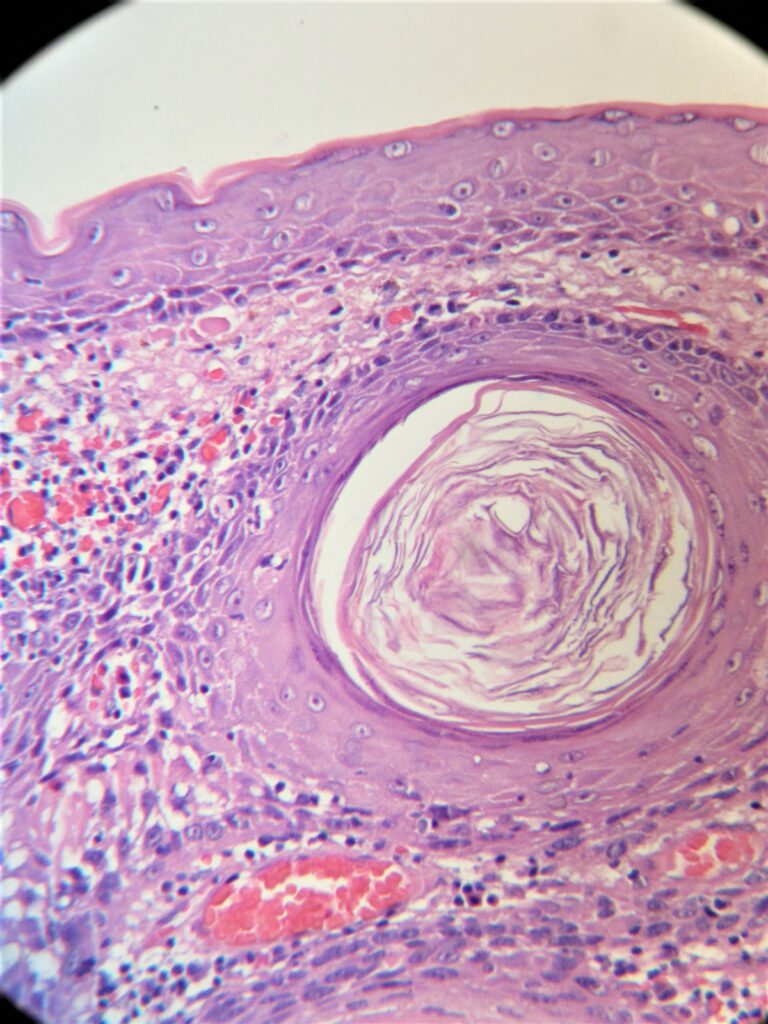
Другие генетические аномалии, участвующие в патогенезе ПКР, включают в себя мутации генов BCL2 и RAS. Вероятно, в развитии ПКР играет роль повреждение во внутриклеточном пути передачи сигнала, затрагивающие рецепторы эпидермального фактора роста и циклооксигеназы. ПКР in situ (болезнь Боуэна) — предшественник инвазивного ПКР. Характерные для него изменения — атипия ядер, частые митозы, клеточный плеоморфизм, дискератоз, паракератоз и гиперкератоз. ПКР in situ дифференцируют с актиническим кератозом, схожим предраковым поражением кожи, для первого характерно вовлечение в патологический процесс всей толщи эпидермиса. Инвазивный ПКР отличается от ПКР in situ и актинического кератоза инвазией появляющихся злокачественных клеток в базальную мембрану. При инвазивном ПКР в дерме обнаруживаются окруженные воспалительным инфильтратом гнезда атипичных клеток.
Принято делить ПКР на следующие гистологические виды, основанные на степени ядерной атипии и кератинизации:
- высокодифференцированный — кератиноциты с преимущественно нормальными ядрами и обильной цитоплазмой, межклеточные кератиновые жемчужины;
- умеренно дифференцированный — промежуточный вариант между высоко и низкодифференцированными вариантами;
- низкодифференцированный — высокая степень ядерной атипии, большое ядерно-цитоплазматического отношение и меньшая кератинизация;
- недифференцированный — эпителиальные клетки, которые могут быть с трудом отличимы от мезенхимальных клеток, клеток меланомы или лимфомы.
Другие гистологические варианты включают акантолитический (аденоидный) ПКР, который характеризуется псевдожелезистыми структурами, и веретеноклеточным ПКР, который имеет атипичные, веретеновидные клетки. Оба варианта протекают агрессивно.
Эпидемиология
Несмотря на увеличивающиеся знания и обучение населения о причинах рака кожи и важности избегания нахождения на солнце, частота ПКР растет по всему миру. Исследование из Южной Кореи оценивало частоту рака между 1999 и 2014 и выявило, что частота стабильно росла на протяжении этих лет, со средней повышением на 3,3 и 6,8% среди мужчин и женщин. В Рочестере (Миннесота) годовой прирост ПКР на 100000 женщин составил 47 случаев в 1984-1986 и 100 случаев в 1990-1992, соответствующая частота среди мужчин — со 126 до 191 случая на 100000 населения. Этот прирост имеет разные причины: обсуждаются причины — старение населения, улучшение выявления, увеличение числа соляриев и внешних факторов, таких как истончение озонового слоя. Дополнительно увеличивается число пациентов с иммуносупрессией после трансплантаций органов, с различными ревматологическими и дерматологическими заболеваниями. Как выше отмечалось, пациенты с донорскими органами имеют значительно повышенный риск возникновения ПКР. Метастазирование также более часто в этой группе.
Пациенты, которые живут близко к экватору имеют тенденцию к возникновению ПКР в более молодом возрасте, чем пациенты, живущие в других широтах. Самая высокая частота ПКР в Австралии — частота заболеваемости 1,17 на 100, что в 5 раз выше, чем у всех других раков вместе взятых. Такая высокая частота, вероятно, имеет место из-за многочисленного светлокожего населения этого региона, подвергающегося избыточному воздействию солнца.
ПКР возникает у мужчин в 2-3 раза чаще, чем у женщин. Предполагается, что причина кроется в профессиональных вредностях — воздействие УФ или других профессиональных вредностей, таких как сажа, масло и гудрон. Средний возраст дебюта ПКР около 70 лет. Но это значение широко варьирует и может наблюдаться и гораздо более молодом возрасте у пациентов из группы риска (например, у пациентов с донорскими органами и с буллезным эпидермолизом).
Клиническая картина
Примерно 70% всех ПКР возникают на голове и шее, чаще всего поражая нижнюю губу, наружное ухо и околоушную область или лоб и волосистую часть головы.
Часто появлению ПКР предшествует актинический кератоз. Он выглядят как шелушащиеся бляшки или папулы, часто с эритематозным основанием. Цвет актинического кератоза варьируется от телесного до розового или коричневого. У пациентов с множественными актиническими кератозами риск развития рака кожи в течение жизни составляет 6–10%.
Классические проявления ПКР — небольшая язва с подрытыми краями, часто покрытая корочками, располагающаяся на участках кожи, подверженных солнечному излучению. Типичные поверхностные изменения могут также включать: шелушение, изъязвление, корки, кожный рог (твёрдый вертикальный вырост кожи). Реже ПКР характеризуется розовым узелком кожи без поверхностных изменений.
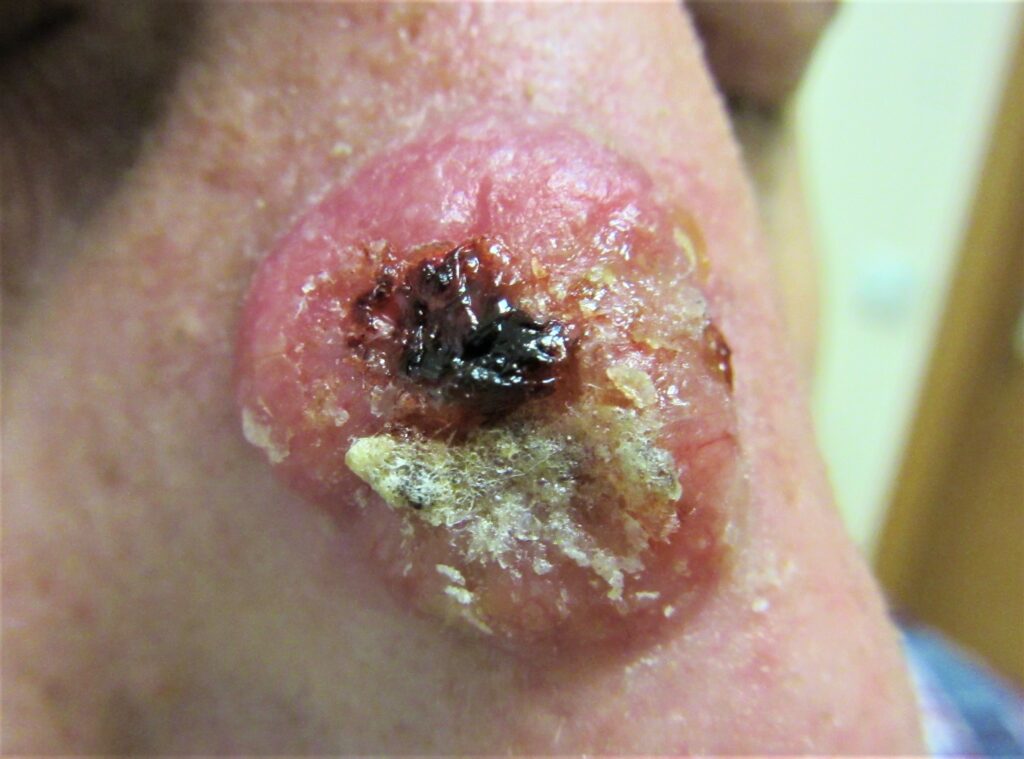
ПРК головы и шеи может распространяться в лимфоузлы в околоушной, поднижнечелюстной и шейной областях.
В дополнении к общим признакам следует обращать внимание на размер и место образования, что имеет значение для прогноза и лечения. Например, опухоль более 2 см и находящаяся на ушной раковине или губе имеет более высокий риск метастазирования. Кроме того, размер и локализация опухоли определяет косметические и функциональные последствия хирургического лечения. Опухоли, расположенные около критических мест, таких как периорбитальная область, может потребовать привлечения пластического хирурга уже в самом начале лечения.
До 14% ПКР имеют периневральную инвазию. Признаки дисфункции черепных нервов при осмотре должны вызывать опасения относительно данного процесса. Наиболее часто поражаются черепные нервы лицевого и тройничного нервов.
Частота местных метастазов составляет 2-6%. Метастазирование из ПКР лба, висков, век, щёк и уха происходит в узлы около слюнных желез, из губ и периоральной области — в подподбородочные и поднижнечелюстные (верхние шейные) лимфоузлы.
Особую форму представляет ПКР конъюнктивы глаза, проявляющийся как хронический, односторонний, ограниченный участок покраснения или диффузного конъюнктивита. Также он может проявляться, как образование на внутреннем углу глаза в спайке между веками или как образование с махровой красной или плоской белой поверхностью.
Дифференциальный диагноз
Старческий кератоз, аллергический контактный дерматит, атопический дерматит, атипичная фиброксантома, базалиома, бовеноидный папулез, гангренозная пиодермия, псевдоэпителиоматозная гиперплазия, кератоакантома, вирусные папилломы.
Лабораторные исследования
Как и в случае любой другой кожной опухоли любой области, должна быть проведена биопсия. Для большинства опухолей это возможно сделать амбулаторно под местной анестезией. Вид биопсии зависит от размера образования.
При поздней стадии ПКР могут быть полезны КТ или МРТ для определения степени заболевания. КТ полезно для определения наличия инвазии в кости или мягкие ткани, а также для оценки состояния шейных лимфатических узлов, подверженных риску метастазирования. Для оценки периневральной инвазии и орбитального или внутричерепного распространения предпочтительным методом визуализации является МРТ.
Лечение
Лечебные подходы включают в себя:
- полное хирургическое иссечение
- микрохирургия по Мосу
- лучевая терапия в виде дополнения к хирургическому лечению для улучшения результата или в виде самостоятельно лечения у пациентов, где есть ограничения для хирургического лечения
- химиотерапия, например с применением 5-фторурацила и ингибиторов эпидермального фактора роста, при наличии высоких факторов риска
- системная химиотерапия при метастазах ПКР
- иммунотерапия — ингибиторы лиганда запрограммированной смерти 1 (PD-L1) цемиплимаб и пембролизумаб
Прогноз
Хотя изначально ПКР не носит фатального характера, он может вызывать большие проблемы, если оставить его без лечения. Большинство ПКР располагается на голове и шее, где как само клиническое течение заболевания, так и хирургическое лечения на поздних стадий может менять внешний вид. Как многие раки, ПКР стадируют на основе клинических данных, исходя из характеристик опухоли, состояния лимфоузлов и отдаленных метастазов (классификация TNM). Хотя такое стадирование полезно при оценке исходов у групп пациентов с ПКР, это не оценивает риск для пациента в целом. Настоящие методы, оценивающие исход пациента с ПКР, сильно зависят от полноты иссечения. При адекватном лечении большинство пациентов на ранней стадии имеет хороший прогноз (общая выживаемость более 90%). Прогноз для пациентов с поздними стадиями ПКР значительно хуже. При наличии метастазов 5-летняя выживаемость снижается до 25-45%. Характеристики опухоли — расположение, диаметр, глубина и клеточная дифференцировка — позволяют предсказать частоту рецидивов, периневральную инвазию и отдаленные метастазы.
При инвазивном ПКР диаметром менее 2 см вероятность метастазирования составляет 9,1%, а при диаметре более 2 см — 30,3%. Проспективное исследование сообщает о 3-летней болезнь специфической выживаемости в 67% при опухолях диаметром более 4 см, по сравнению с 93% выживаемостью для опухолей менее 4 см. Исследование Eigenter и соавт. показало, что в случае ПКР факторами, обуславливающими высокий риск смерти от рака являются толщина опухоли 6 мм и больше, десмопластический рост и иммуносупрессия.
При увеличении толщины инвазии первичной опухоли ПКР, риск местного рецидива и метастазирования в лимфоузлы повышается, а общая выживаемость снижается. Поражение глубиной 2 мм редко метастазирует; глубиной 2-4 мм имеют частоту рецидива 5,3% и метастазирования 6,7%. Низкодифференцированные опухоли имеют худший прогноз и частоту рецидива в 33-54%. В настоящее время актуальность гистологического стадирования сама по себе, однако, недостаточна ясна, т.к. низкодифференцированные опухоли, которые метастазируют и рецидивируют, обладают более значимыми первичными факторами риска (диаметр, толщина). Тем не менее, низкодифференцированные опухоли в целом считается ведут себя более агрессивно.
Риск рецидива связан с характеристиками опухоли. Например, опухоль размером более 2 см рецидивирует в 15,7% после удаления, низкодифференцированные опухоли — в 25% после удаления, а высокодифференцированные — в 11,8%. Местный рецидив после повторного удаления ПКР варьирует от 10 до 23%. Частота повторного метастазирования достигает 25-45%.
Периневральная инвазия наблюдается у 7% у пациентов с ПКР. Прогноз в таких случаях хуже и частота метастазирования достигает 47%. Гораздо реже о метастазах (8%) сообщается при применении микрографической хирургии по Мосу. Степень повреждения нерва серьёзно влияет на прогноз. Вовлечение больших нервных ветвей предполагает большой риск рецидива. Риски соответственно снижаются, если удалить весь объём поражённого нерва, хотя прогноз в целом все же остается серьёзным. Одно исследование продемонстрировало, что диаметр поражённого нерва существенно влияет на исход ПКР. Смертность, связанная с ПКР, отсутствовала в случае поражения нервов тоньше 0,1 мм, но достигала уже 32% при поражении нервов 0,1 см и более.
Исследование Vasan показало, что у пациентов с метастатическим ПКР раком головы и шеи, у которых соотношение поражённых лимфатических узлов к общему числу резецированных лимфатическим узлам превышало 6%, безрецидивная и общая выживаемость была меньше.
Профилактика
Пациент с предраковыми высыпаниям должен быть проинформирован о необходимости избегать избыточного УФ излучения, путем перенесения активности на открытом воздухе на утренние и вечерние часы, применения защитной одежды, ношения шляп, закрывающих лицо, голову и шею, и ежедневных нанесений солнцезащитных средств с фактором 15 и более. Использование искусственных устройств для загара строго исключаются, т.к. они связаны с 2,5-кратным риском развития ПКР. Изменения кожи могут вновь появиться даже спустя годы, поэтому пациенты должны приходить на плановые осмотры. Кроме того пациенты должны быть проконсультированы в отношении лечения участков кожи с хроническим воспалением или травмой с целью профилактики развития ПКР на этих местах. Эти меры также исключительно важны для пациентов с иммуносупрессией и они должны быть составной частью образовательных программ для пациентов, которые планируют трансплантацию.
Список литературы
- Muranushi C, Olsen CM, Pandeya N, Green AC. Aspirin and nonsteroidal anti-inflammatory drugs can prevent cutaneous squamous cell carcinoma: a systematic review and meta-analysis. J Invest Dermatol. 2015 Apr. 135(4):975-83.
- Maubec E. Update of the Management of Cutaneous Squamous-cell Carcinoma. Acta Derm Venereol. 2020 Apr 28.
- Corchado-Cobos R, Garcia-Sancha N, Gonzalez-Sarmiento R, Perez-Losada J, Canueto J. Cutaneous Squamous Cell Carcinoma: From Biology to Therapy. Int J Mol Sci. 2020 Apr 22. 21 (8).
- Brash DE. Roles of the transcription factor p53 in keratinocyte carcinomas. Br J Dermatol. 2006 May. 154 Suppl 1:8-10.
- Hanneman KK, Cooper KD, Baron ED. Ultraviolet immunosuppression: mechanisms and consequences. Dermatol Clin. 2006 Jan. 24(1):19-25.
- Pedersen SA, Gaist D, Schmidt SAJ, Holmich LR, Friis S, Pottegard A. Hydrochlorothiazide use and risk of nonmelanoma skin cancer: A nationwide case-control study from Denmark. J Am Acad Dermatol. 2018 Apr. 78 (4):673-81.e9.
- de Gruijl FR, Rebel H. Early events in UV carcinogenesis—DNA damage, target cells and mutant p53 foci. Photochem Photobiol. 2008 Mar-Apr. 84(2):382-7.
- Ziegler A, Jonason AS, Leffell DJ, Simon JA, Sharma HW, Kimmelman J, et al. Sunburn and p53 in the onset of skin cancer. Nature. 1994 Dec 22-29. 372(6508):773-6..
- Perry PK, Silverberg NB. Cutaneous malignancy in albinism. Cutis. 2001 May. 67(5):427-30.
- Euvrard S, Kanitakis J, Decullier E, et al. Subsequent skin cancers in kidney and heart transplant recipients after the first squamous cell carcinoma. Transplantation. 2006 Apr 27. 81(8):1093-100.
- Wilkins K, Turner R, Dolev JC, LeBoit PE, Berger TG, Maurer TA. Cutaneous malignancy and human immunodeficiency virus disease. J Am Acad Dermatol. 2006 Feb. 54(2):189-206; quiz 207-10.
- Rogers HW, Weinstock MA, Feldman SR, Coldiron BM. Incidence Estimate of Nonmelanoma Skin Cancer (Keratinocyte Carcinomas) in the U.S. Population, 2012. JAMA Dermatol. 2015 Oct. 151 (10):1081-6.
- Oh CM, Cho H, Won YJ, et al. Nationwide Trends in the Incidence of Melanoma and Non-melanoma Skin Cancers from 1999 to 2014 in South Korea. Cancer Res Treat. 2017 Jul 14.
- Gray DT, Suman VJ, Su WP, Clay RP, Harmsen WS, Roenigk RK. Trends in the population-based incidence of squamous cell carcinoma of the skin first diagnosed between 1984 and 1992. Arch Dermatol. 1997 Jun. 133(6):735-40.
- Staples MP, Elwood M, Burton RC, Williams JL, Marks R, Giles GG. Non-melanoma skin cancer in Australia: the 2002 national survey and trends since 1985. Med J Aust. 2006 Jan 2. 184(1):6-10.
- Ross AS, Whalen FM, Elenitsas R, Xu X, Troxel AB, Schmults CD. Diameter of involved nerves predicts outcomes in cutaneous squamous cell carcinoma with perineural invasion: an investigator-blinded retrospective cohort study. Dermatol Surg. 2009 Dec. 35(12):1859-66.
- Vasan K, Low TH, Gupta R, et al. Lymph node ratio as a prognostic factor in metastatic cutaneous head and neck squamous cell carcinoma. Head Neck. 2018 Jan 23.
- Salasche SJ. Epidemiology of actinic keratoses and squamous cell carcinoma. J Am Acad Dermatol. 2000 Jan. 42(1 Pt 2):4-7.
- Hasmat S, Mooney C, Gao K, et al. Regional Metastasis in Head and Neck Cutaneous Squamous Cell Carcinoma: An Update on the Significance of Extra-Nodal Extension and Soft Tissue Metastasis. Ann Surg Oncol. 2020 Aug. 27 (8):2840-5.
- Papaioannou IT, Melachrinou MP, Drimtzias EG, Gartaganis SP. Corneal-conjunctival squamous cell carcinoma. Cornea. 2008 Sep. 27(8):957-8.
- Baart VM, van Duijn C, van Egmond SL, et al. EGFR and αvβ6 as Promising Targets for Molecular Imaging of Cutaneous and Mucosal Squamous Cell Carcinoma of the Head and Neck Region. Cancers (Basel). 2020 Jun 5. 12 (6).
- Baggi A, Quaglino P, Rubatto M, et al. Real world data of cemiplimab in locally advanced and metastatic cutaneous squamous cell carcinoma. Eur J Cancer. 2021 Sep 15. 157:250-8.
- Migden MR, Rischin D, Schmults CD, et al. PD-1 Blockade with Cemiplimab in Advanced Cutaneous Squamous-Cell Carcinoma. N Engl J Med. 2018 Jul 26. 379 (4):341-351.
- Zhang GL, Keyal U, Shi L, et al. Photodynamic therapy as an alternative treatment in patients with invasive cutaneous SCC where surgery is not feasible: Single center experience. Photodiagnosis Photodyn Ther. 2020 Dec. 32:101980.
- Keohane SG, Botting J, Budny PG, et al. British Association of Dermatologists guidelines for the management of people with cutaneous squamous cell carcinoma 2020. Br J Dermatol. 2021 Mar. 184 (3):401-14.
- Mohan SV, Chang J, Li S, Henry AS, Wood DJ, Chang AL. Increased Risk of Cutaneous Squamous Cell Carcinoma After Vismodegib Therapy for Basal Cell Carcinoma. JAMA Dermatol. 2016 May 1. 152 (5):527-32.