Введение
Меланома — это злокачественное новообразование из меланоцитов или клеток, развивающихся из меланоцитов. Долгие годы она считалась редким заболеванием, но за последние несколько десятилетий ежегодная заболеваемость ею резко возросла. Хирургическое вмешательство является эффективным методом лечения меланомы на ранней стадии, медикаментозное лечение обычно представляет собой адъювантное лечение местно-распространённой меланомы высокого риска и метастатического процесса.
Этиология
Меланомы возникают из меланоцитов, которые развиваются в эмбриогенезе из нервного гребня и мигрируют в эпидермис, мозговые и слизистую оболочки. Меланоциты, которые находятся в коже и производят защитный меланин, располагаются в базальном слое эпидермиса. Меланомы могут развиваться на месте ранее существовавшего предшественника или рядом с ним, или на здоровой на вид коже. Статистически выявлено, что чаще меланомы развиваются de novo, т.е. на коже без меланоцитарных образований. Многие из этих меланом вызваны солнечным облучением. Опухоль также может возникать на ладонях, подошвах и промежности. Некоторые невусы считаются предшественниками меланомы: обычный приобретённый, диспластический, врождённый, голубой клеточный.
В развитии меланомы участвуют многие гены, включая CDKN2A (p16), CDK4, RB1, CDKN2A (p19), PTEN/MMAC1 и ras. CDKN2A (p16), по-видимому, особенно важен как при спорадических, так и при наследственных меланомах. Этот ген-супрессор опухоли расположен на участке 9p21, и его мутация играет роль в различных видах рака.
Воздействие ультрафиолетового (УФ) излучения является решающим фактором в развитии большинства меланом. Ультрафиолетовый свет A (UVA) с длиной волны 320–400 нм и ультрафиолет B (UVB) с длиной волны 290–320 нм потенциально канцерогенны и фактически могут совместно вызывать меланому. УФ излучение, по-видимому, является эффективным индуктором меланомы посредством многих механизмов, включая подавление иммунной системы кожи, индукцию деления меланоцитов, выработку свободных радикалов и повреждение ДНК меланоцитов.
Интересно, что меланома не имеет прямой связи с количеством пребывания на солнце, поскольку она чаще встречается у рабочих офисов, чем у тех, кто работает на открытом воздухе.
Острые, интенсивные и повторяющиеся солнечные ожоги с образованием пузырей, особенно на участках тела, которые лишь изредка подвергаются воздействию солнца, являются наибольшим фактором риска развития меланомы, вызванной воздействием солнца. Этот фактор риска, связанный с солнцем, отличается от фактора риска плоскоклеточного и базальноклеточного рака кожи, который связан с длительным пребыванием на солнце.
Меланома типа злокачественного лентиго (лентиго-меланома) является исключением из этого правила, поскольку часто появляется на голове и шее у пожилых людей, которые в анамнезе имеют длительное нахождение на солнце.
Ретроспективный анализ случай-контроль, проведённый в клинике Мейо, выявил, что у пациентов с болезнью Паркинсона риск наличия ранее существовавшей меланомы был увеличен в 4 раза, а пациенты с меланомой имеют аналогичный риск развития болезни Паркинсона. Эти результаты подтверждают исследования других исследователей, показывающие повышенный риск развития меланомы у пациентов с болезнь Паркинсона.
Важно отметить, что существуют и другие факторы, которые могут предрасполагать к развитию к меланомы. Факторы, значительно повышающие риска развития меланомы кожи, включают: изменение родинки, диспластические невусы в сочетании с меланомой у члена семьи, более 50 невусов диаметром 2 мм и более. К умеренному риску относят: меланому у члена семьи, уже возникшая меланома, единичные диспластические невусы, врождённый невус. К слабому риску относят: иммуносупрессию, чувствительность к солнцу, острые, тяжёлые солнечные ожоги 2 степени, веснушки.
Патофизиология
Меланомы имеют две фазы роста: радиальную и вертикальную. Во время фазы радиального роста злокачественные клетки растут в эпидермисе радиально. Со временем большинство меланом переходят в фазу вертикального роста, при которой злокачественные клетки проникают в дерму и приобретают способность метастазировать.
Несколько исследований показали, что распространение меланомы является результатом генетических мутаций и изменений микроокружения опухоли, характеризующихся сверхэкспрессией белков, способствующих инвазии и инфильтрации. В частности, ключевую роль играет сверхэкспрессия матриксных металлопротеиназ (ММП), особенно ММП-9 и ММП-2, которые индуцирует деградацию компонентов внеклеточного матрикса, способствуя тем самым инфильтрации и распространению опухолевых клеток по кровотоку. Сверхэкспрессия этих белков и изменения микроокружения опухоли опосредованы генетическими изменениями и нарушением регуляции путей NF-κB. Было продемонстрировано, что сверхэкспрессия MMP-9, наблюдаемая при меланоме, вызвана явлениями внутригенного метилирования, которые приводят к сверхэкспрессии белка. Кроме того, также было продемонстрировано, что NF-κB индуцирует сверхэкспрессию MMP-9 путем активации остеопонтина, другого белка микроокружения опухоли, тем самым играя фундаментальную роль в развитии и прогрессировании меланомы.
Помимо изменений микроокружения опухоли роль в распространении меланомы отводят тяжёлых соматическим генетическим изменениям. Наиболее частые соматические мутации в меланомах, расположенных на коже подверженной воздействию солнечных лучей, затрагивают гены, которые контролируют пролиферацию (BRAF, NRAS и NF1), рост и метаболизм (PTEN, KIT), устойчивость к апоптозу (TP53), контроль клеточного цикла (CDKN2A) и репликативную продолжительность жизни (TERT). Эти геномные изменения обычно приводят к аберрантной активации двух основных сигнальных путей при меланоме: сигнального каскада RAS/RAF/MEK/ERK (путь MAPK) и фосфоинозитол-3-киназы (путь PI3K).
Путь MAPK физиологически участвует в передаче внеклеточных сигналов, таких как факторы роста и гормоны, в ядро, что приводит к экспрессии генов, которые являются центральными движущими силами пролиферации, дифференциации и выживания клеток. Кроме того, было показано, что активация MAPK играет решающую роль в биологии различных типов рака и является наиболее частым путем, аберрантно активируемым при меланоме. Путь PI3K обычно участвует в клеточном гомеостазе, и было показано, что его активация играет центральную роль при различных типах рака, включая меланому, где он является вторым наиболее часто активируемым путем.
До 90% меланом демонстрируют аберрантную активацию пути MAPK, и это является центральным этапом развития меланомы, поскольку он отвечает за дерегуляцию клеточного цикла и ингибирование апоптоза. Среди различных механизмов, ответственных за аномальную передачу сигналов пути MAPK при меланоме, наиболее частыми генетическими аномалиями являются, безусловно, мутации BRAF. От 37 до 50% меланом несут соматическую мутацию в гене BRAF, причём самая высокая частота встречается в меланомах кожи, возникающих в результате периодического воздействия солнечных лучей (приблизительно 60% несут мутацию BRAF). Обычно мутации BRAF, обнаруживаемые при меланоме кожи, представляют собой миссенс-мутации с заменой валина. Примерно 80–90% мутаций BRAF представляют собой V600E (замена валина на глутаминовую кислоту), 5–12% V600K (валин на лизин) и <5% составляют V600D (валин в аспарагиновую кислоту) или V600R (валин в аргинин).
Белок BRAF представляет собой серин/треониновую протеинкиназу, состоящую из 766 аминокислот, организованных в 3 домена: 2 с регуляторной функцией и 1 каталитический домен, ответственный за фосфорилирование MEK. Каталитический домен также отвечает за поддержание белка в его неактивной конформации посредством гидрофобного взаимодействия между так называемой богатой глицином петлей и активационным сегментом, что делает его недоступным для связывания АТФ. При мутации BRAF V600E гидрофобный валин заменяется полярной гидрофильной глутаминовой кислотой, что приводит к аномальному перевороту каталитического домена, который приобретает активную конформацию с киназной активностью, в 500 раз превышающей активность киназы BRAF дикого типа. Большинство мутаций BRAF, отличных от V600E, действуют аналогичным образом посредством изменения взаимодействия богатой глицином петли и сегмента активации, тем самым увеличивая киназную активность BRAF.
Вторая наиболее распространенная причина аберрантной передачи сигналов по пути MAPK при меланоме кожи связана с мутациями, активирующими NRAS. NRAS мутирует в 15–30% меланом, и в большинстве случаев эти мутации представляют собой миссенс-мутации кодона 12, 13 или 61 (последние составляют 80% всех мутаций NRAS при меланоме). Мутации этих кодонов приводят к продлению NRAS-активного состояния, связанного с гуанозинтрифосфатом, тем самым аномально поддерживая передачу сигналов NRAS как по путям MAPK, так и по путям PI3K. Важно отметить, что мутации NRAS и BRAF считаются взаимоисключающими; комутации могут возникать редко (приблизительно 0,5% у пациентов, ранее не получавших лечения).
NF1 представляет собой ген-супрессор опухоли, мутирующий в 10–15% случаев меланомы, и является третьим наиболее часто мутирующим геном в меланоме. Белок NF1 регулирует семейство RAS путем преобразования активного RAS-гуанозинтрифосфата в неактивный RAS-гуанозиндифосфат, тем самым ингибируя нижестоящую передачу сигналов RAS. Следовательно, потеря функции NF1 определяет гиперактивацию белка NRAS и, таким образом, усиление передачи сигналов путей MAPK и PI3K. Геномные изменения NF1 чаще встречаются при меланомах, связанных с хроническим воздействием солнечных лучей, и обычно связаны с большим количеством различных геномных мутаций, включая сочетание с мутациями BRAF или NRAS.
Рецепторная тирозинкиназа KIT физиологически участвует в пролиферации и выживании меланомы посредством путей PI3K/AKT и RAS/RAF/MEK/ERK. Соматические активирующие мутации в этом гене обнаруживаются в 2–8% всех злокачественных меланом и чаще встречаются в акральных меланомах и меланомах, возникающих на коже, периодически подвергающейся воздействию солнечных лучей.
Эпидемиология
По оценкам Американского онкологического общества в 2024 в США будет диагностировано 100 640 случаев инвазивной меланомы кожи (59 170 у мужчин и 41 470 у женщин), а также 99 700 случаев меланомы in situ. С начала 2000-х годов уровень заболеваемости меланомой у лиц моложе 50 лет среди женщин стабилизировался и снижался примерно на 1% в год у мужчин; у взрослых в возрасте 50 лет и старше показатели повышались у женщин примерно на 3% в год, но стабилизировались у мужчин.
Хотя меланома составляет лишь около 1% случаев рака кожи, она является причиной подавляющего большинства смертей от рака кожи. По оценкам Американского онкологического общества в США в 2024 от меланомы умрут 8290 человек (5430 мужчин и 2860 женщин).
Во всем мире заболеваемость злокачественной меланомой быстро возросла за последние 50 лет, при этом самая высокая заболеваемость приходится на светлокожее население и в географических районах, наиболее близких к экватору. Австралия и Новая Зеландия имеют самый высокий уровень заболеваемости меланомой в мире: стандартизированный по возрасту показатель составляет 32,5 случаев на 100 000 населения.
Меланома чаще встречается у белых, чем у чернокожих и азиатов. Уровень заболеваемости меланомой среди чернокожих оценивается в одну двадцатую от показателя среди белых. Белые люди с тёмной кожей также имеют гораздо меньший риск развития меланомы, чем люди со светлой кожей. Типичный пациент с меланомой имеет светлую кожу и склонность к солнечным ожогам, а не к загару. Белые люди со светлыми или рыжими волосами и многочисленными веснушками, по-видимому, наиболее склонны к меланоме. На Гавайях и юго-западе США у белых наблюдается самая высокая заболеваемость, примерно 20-30 случаев на 100 000 населения в год.
Меланома может возникнуть в любом возрасте, хотя у детей младше 10 лет меланома de novo развивается редко. Средний возраст на момент постановки диагноза составляет 66 лет, а 80% пациентов — от 45 до 84 лет.
Клиническая картина
Важную роль играет сбор данных семейного анамнеза в отношение меланомы или рака кожи. Кроме того, важен семейный анамнез наличия неровных, заметных родинок. Примерно 10% всех пациентов с меланомой имеют семейный анамнез меланомы. У этих пациентов меланома обычно развивается в более раннем возрасте и, как правило, имеются множественные диспластические невусы. У этих пациентов также чаще наблюдаются множественные первичные заболевания.
Наличие синдрома семейной меланомы следует предполагать у пациентов с семейным анамнезом рака поджелудочной железы или астроцитомы. Мутации в гене-супрессоре опухолей CDKN2A (также известном как p16) являются наиболее распространенными генетическими аномалиями, обнаруживаемыми в этих семьях.
У пациентов необходимо выяснить наличие меланомы ранее, поскольку у них повышен риск развития второй меланомы. Множественные первичные меланомы особенно распространены у пациентов с множественными диспластическими невусами. Термин «синдром множественных атипичных невусов» (FAMM синдром) используется для описания этой наследственной склонности развития множественных диспластических невусов и меланом.
Также важен сбор анамнеза в отношении нахождения на солнце и наличию тяжёлых солнечных ожогов с самого детства, и склонности к загару или покраснение кожи. Полезной может быть информация полученная от пациента или его родственников о любых изменениях, отмеченных в родинках (изменений размера, цвета или симметрии, наличии кровотечении или изъязвления.
Осмотр кожи всего тела имеет решающее значение при обследовании пациента с атипичными невусами или меланомой. Осмотр кожи следует проводить при первоначальном осмотре пациента и во время всех последующих визитов. Исследование, проведённое в общей дерматологической практике, показало, что большинство меланом, диагностированных в течение 3-летнего периода, не были основной жалобой, а были обнаружены только потому, что дерматолог провел обследование всей кожи; более того, эти случайно обнаруженные меланомы с большей вероятностью были более тонкими или представляли собой поражения in situ и, следовательно, лучше поддавались лечению.
Во время осмотра кожи оценивают общее количество невусов, присутствующих на коже пациента и руководствуются правилом ABCDE и “гадкого утёнка”. Значительное место в практике врача получили анализ серийных фотографии, дерматоскопия и компьютерный анализ изображений.
Выделяют несколько основных типов меланом. Примерно 70% злокачественных меланом кожи относятся к поверхностно-распространяющейся меланоме (ПРМ). Многие ПРМ возникают из пигментных диспластических невусов, часто стабильных в течение длительного времени. Типичные изменения включают изъязвление, увеличение или изменение цвета. Их можно обнаружить на любой поверхности тела, особенно на голове, шее и туловище мужчин и нижних конечностях женщин.
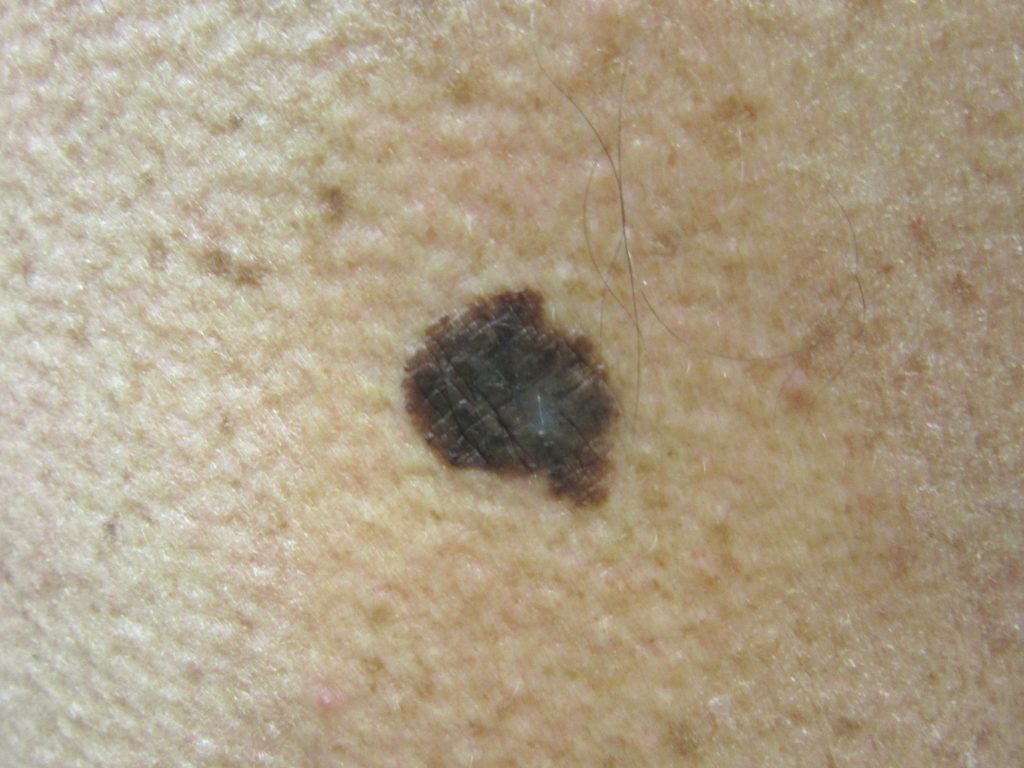
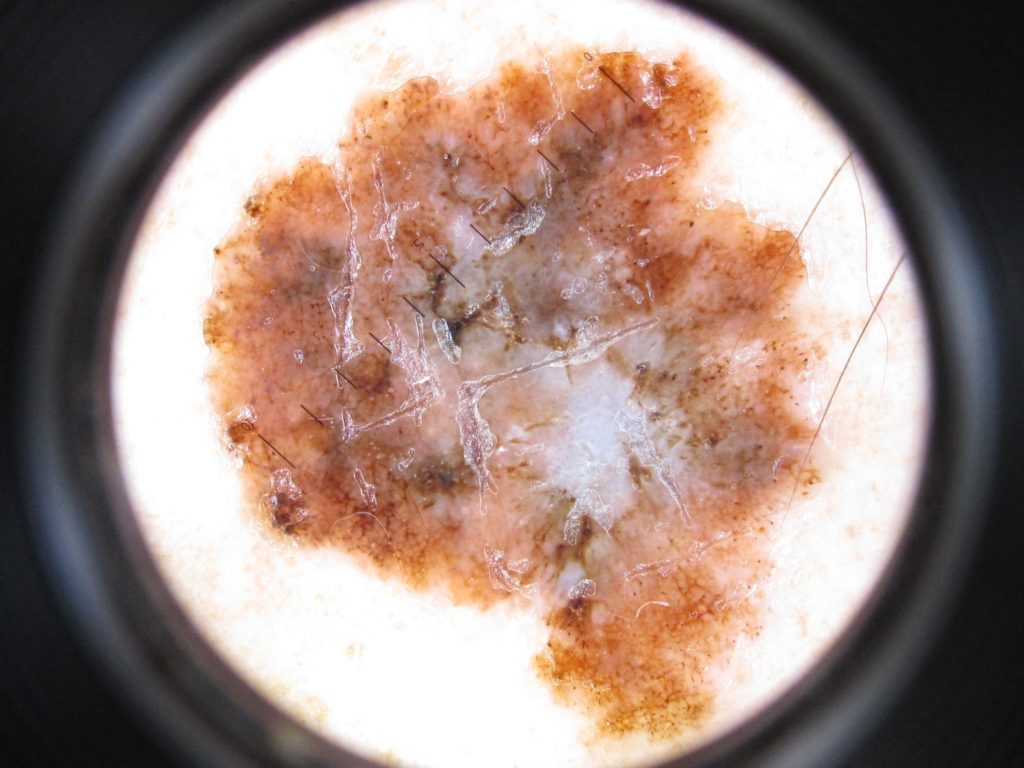
Узловые меланомы (УМ) составляют примерно 10–15% меланом и обычно обнаруживаются на всех участках тела, особенно часто на теле у мужчин. Эти поражения являются наиболее симметричными и однородными среди типов меланом и имеют тёмно-коричневый или чёрный цвет. Фаза радиального роста может быть неочевидна; но, если эта фаза очевидна, то кратковременна, поскольку опухоль быстро переходит в фазу вертикального роста. Примерно 5% всех УМ представляют собой амеланотические меланомы.
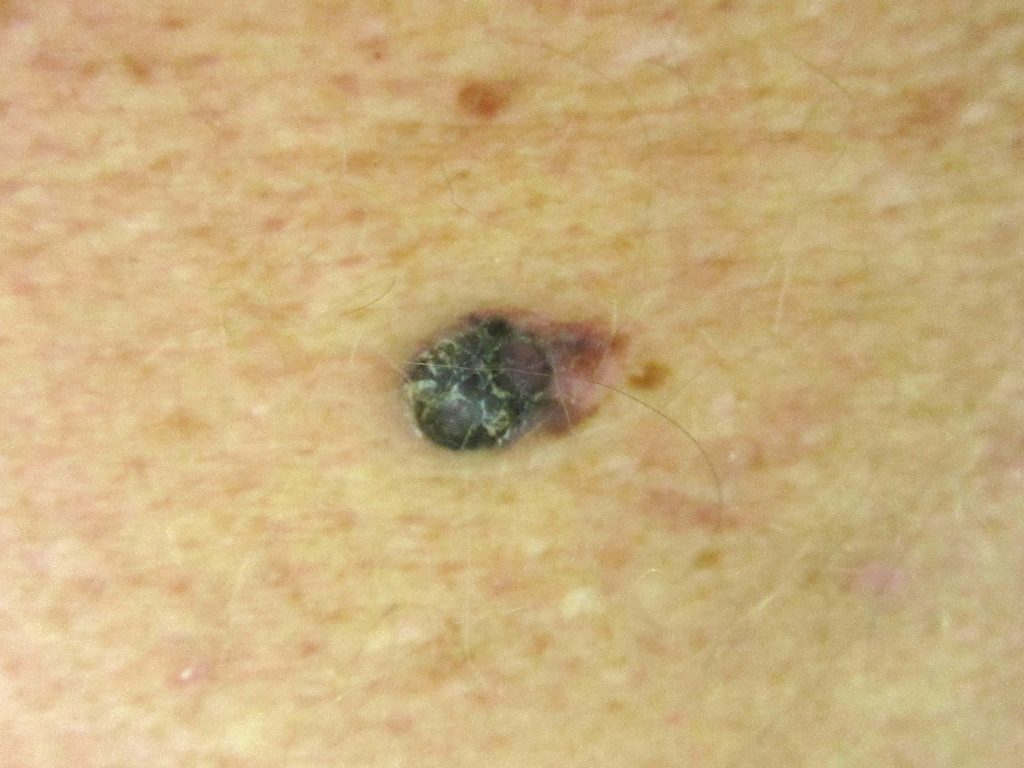
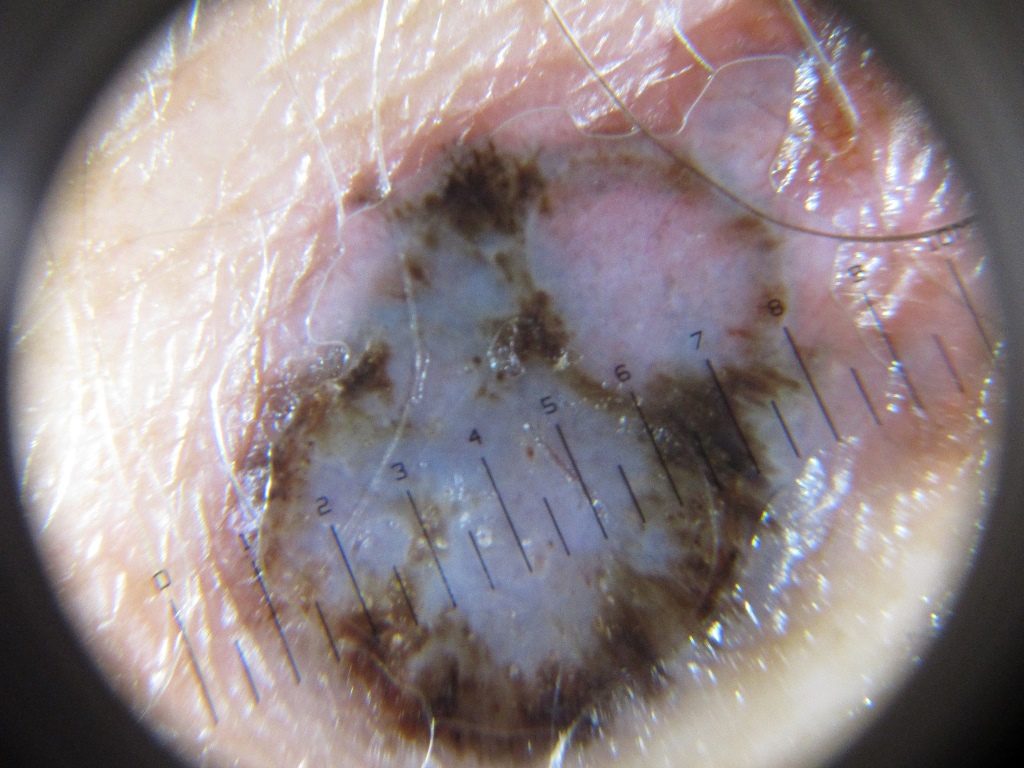
Лентиго-меланома также составляют 10-15% меланом. Обычно они обнаруживаются на участках, подверженных воздействию солнца (например, руки, шея). Опухоль может иметь участки гипопигментации и часто бывают довольно большими. Лентиго-меланома возникает из предшественника, злокачественного лентиго/меланоза Дюбрейля.
Акрально-лентигинозные меланомы (АЛМ) — единственные меланомы, которые встречаются с одинаковой частотой у чернокожих и белых людей. Они возникают на ладонях, подошвах и под ногтями. Подногтевые меланомы часто принимают за подногтевые гематомы. Как и УМ, АЛМ чрезвычайно агрессивна и быстро переходит от радиальной фазы роста к вертикальной.
Лентигинозные меланомы слизистой оболочки развиваются из эпителия слизистой оболочки, выстилающей дыхательные, желудочно-кишечные и мочеполовые тракты. Они встречаются редко и составляют лишь 0,8–1,8% всех меланом (в США). Некожные меланомы обычно диагностируются у пациентов пожилого возраста. Они, по-видимому, имеют более агрессивное течение, чем меланомы кожи, хотя отчасти это может быть связано с тем, что они обычно диагностируются на более поздней стадии. Кроме того, генетические изменения и онкогенные причины меланомы слизистой оболочки отличаются от таковых при меланоме кожи. Мутации BRAF и NRAS , которые являются распространенными факторами меланомы кожи, реже обнаруживаются при меланоме слизистой оболочки, тогда как мутации SF3B1 и KIT обнаруживаются чаще.
Если у пациента диагностирована меланома, исследуют все группы лимфатических узлов. Меланома может распространяться по лимфатическим путям, приводя к поражению регионарных лимфатических узлов; и гематогенно, приводя к поражению любого узла организма.
Стадирование и прогноз
Определение стадии при меланоме имеет определяющее значение. Небольшие меланомы на ранних стадиях легко излечимы хирургическим удалением, пациенты с далеко зашедшим метастатическим поражением имеют ограниченные терапевтические возможности со средней выживаемостью всего 6-9 месяцев.
К наиболее важным прогностическим факторам относятся следующие: толщина и/или уровень инвазии; митотический индекс (митозов на миллиметр); изъязвление или кровотечение первичной опухоли; количество поражённых регионарных лимфатических узлов; системные метастазы; уровень лактатдегидрогеназы.
В целом, к положительным прогностическим факторам относятся следующие: молодой возраст, женский пол, меланома, расположенная на конечностях.
Прогноз хуже у пациентов с ослабленным иммунитетом (например, у реципиентов трансплантатов органов, у людей с ВИЧ-инфекцией).
У пациентов с меланомой слизистой оболочки многофакторный анализ показал, что расположение первичной опухоли является независимым предиктором общей выживаемости и выживаемости при конкретном заболевании. Опухоли в полости носа и полости рта были связаны с более высокой выживаемостью по сравнению с опухолями в носоглотке и околоносовых пазухах.
Для оценки стадии процесса применяется классификация TNM.
Т (толщина опухоли):
Тх: первичную опухоль невозможно оценить
Т0: нет признаков первичной опухоли
Тis: Меланома in situ
Т1: ≤1,0 мм (изъязвление неизвестно или неуточнено)
Т1а: <0,8 мм без изъязвлений
T1b: <0,8 мм с изъязвлением; 0,8-1,0 мм с изъязвлением или без него
Т2: >1,0–2,0 мм (изъязвление неизвестно или неуточнено)
Т2а: >1,0-2,0 мм без изъязвлений
Т2b: >1,0-2,0 мм с изъязвлением
Т3: >2,0–4,0 мм (изъязвление неизвестно или неуточнено)
Т3а: >2,0–4,0 мм без изъязвлений
Т3b: >2,0–4,0 мм с изъязвлением
Т4: >4,0 мм (изъязвление неизвестно или неуточнено)
Т4а: >4,0 мм без изъязвлений
T4b: >4,0 мм с изъязвлением
N (регионарные лимфатические узлы и/или лимфогенные метастазы):
NX: региональные узлы не оценены
N0: Регионарные метастазы не обнаружены
N1: один узел, пораженный опухолью; или транзитные, сателлитные и/или микросателлитные метастазы без пораженных опухолью узлов
N1a: один клинически непоражённый (т.е. обнаруженный при биопсии сторожевого лимфатического узла); отсутствие транзитных, сателлитных или микросателлитных метастазов
N1b: один клинически обнаруженный; отсутствие транзитных, сателлитных или микросателлитных метастазов
N1c: нет поражения регионарных лимфатических узлов; обнаружены транзитные, сателлитные и/или микросателлитные метастазы
N2: два или три узла, поражённых опухолью; или транзитные, сателлитные или микросателлитные метастазы
N2a: два или три клинически непоражёные; отсутствие транзитных, сателлитных или микросателлитных метастазов
N2b: клинически выявлено два или три; отсутствие транзитных, сателлитных или микросателлитных метастазов
N2c: один клинически непораженный или клинически непоражённый; обнаружены транзитные, сателлитные и/или микросателлитные метастазы
N3: ≥4 поражённых опухолью узлов или транзитные, сателлитные и/или микросателлитные метастазы с ≥2 поражёнными опухолью узлами или любое количество спутанных узлов без или с транзитными, сателлитными и/или микросателлитными метастазами
N3a: ≥4 клинически клинически непоражённых; отсутствие транзитных, сателлитных или микросателлитных метастазов
N3b: ≥4, хотя бы один из которых был обнаружен клинически, или наличие любых спаянных узлов; отсутствие транзитных, сателлитных или микросателлитных метастазов
N3c: ≥2 клинически обнаруженных или клинически выявленных и/или наличие любых спаянных узлов с наличием транзитных, сателлитных и/или микросателлитных метастазов.
Микрометастазы диагностируются после селективной лимфаденэктомии или биопсии сторожевого лимфоузла. Макрометастазы определяются как клинически обнаруживаемые метастазы в лимфоузлы, подтвержденные лимфаденэктомией, или когда метастазы в лимфоузлах демонстрируют значительное экстракапсулярное распространение.
М (гематогенные метастазы):
М0: нет признаков отдаленных метастазов
M1a: Отдаленные кожные, подкожные или нерегионарные метастазы в лимфоузлах
M1a: Отдаленные кожные, подкожные или нерегионарные метастазы в лимфоузлах
M1b: метастазы в лёгкие с вовлечением M1a или без него
M1c: Отдаленные метастазы в висцеральные участки за пределами центральной нервной системы (ЦНС) с вовлечением M1a или M1b или без него
M1d: Отдалённые метастазы в ЦНС с вовлечением M1a-c или без него.
Уровень лактатдегидрогеназы (ЛДГ): присваивается суффикс (0) для нормального уровня ЛДГ или (1) для повышенного уровня.
Стадирование AJCC выглядит следующим образом:
Стадия 0 — Тis/N0/M0
Стадия IA — Т1а/N0/M0
Стадия IB — T1b, T2b/ N0/ M0
Стадия IIA — T2b, Т3a/N0/M0
Стадия IIB — T3b, T4a/N0/M0
Стадия IIC — T4b/N0/M0
Стадия III — любой Т, Tis/≥N1/M0
Стадия IIIA — T1a/b, T2a/N1a, N2a/M0
Стадия IIIB — Т0/N1b, N1c/M0; Т1а-б, Т2а/N1b-c, N2b/М0; Т2б, Т3а/N1a-c, N2a-b/M0
Стадия IIIC — T0/N2b-c, N3b-c/M0; Т1а-Т3а/N2c, N3a-c/M0; T4b/N1a-c, N2a-c/MO
Стадия IV — Любой Т/Любой N/М1
Прогноз зависит от стадии заболевания на момент постановки диагноза. По данным SEER за 2013-2019 годы, 5-летняя относительная выживаемость составила:
локализованный процесс (ограниченный одним местом) — >99,5%
региональный (распространение на регионарные лимфатические узлы) — 74%
отдаленный (метастатический) — 35%.
Для меланомы IV стадии прогноз варьируется в зависимости от места метастазирования. Сандру и соавт. сообщили, что медиана общей выживаемости в зависимости от места метастазирования была следующей: подкожные и лимфатические узлы — 20,8 мес., лёгкие — 13 мес., печень и пищеварительный тракт: 5,5 мес., центральная нервная система — 2,5 мес.
Дифференциальный диагноз
Доброкачественные меланоцитарные поражения, диспластический невус, плоскоклеточная карцинома, метастатические опухоли кожи, голубой невус, эпителиоидная (шпиц) опухоль, пигментированная веретеноклеточная опухоль, гало-невус, атипичная фиброксантома, пигментный актинический кератоз, карцинома сальной железы, гистиоцитоидная гемангиома.
Диагностика
Диагноз меланомы подтверждается эксцизионной биопсией. Биопсия сторожевых лимфатических узлов или анализ генного профиля могут быть полезными для определения прогноза у отдельных пациентов, но имеется мало доказательств того, что они влияют на продолжительность жизни.
На ранних стадиях заболевания лабораторные и визуализирующие исследования назначаются редко. Рутинное тестирование может привести к частым ложноположительным результатам и проведению ненужных исследований.
Один мета-анализ диагностических тестов, используемых для определения стадии меланомы, показал, что ультрасонография является лучшим визуализирующим исследованием для диагностики поражения лимфатических узлов, а позитронно-эмиссионная томография и компьютерная томография (ПЭТ-КТ) являются лучшим визуализирующим исследованием для поиска других мест метастазирования. В целом, эти исследования подходят для пациентов из группы высокого риска или при наличии локальных признаков или симптомов.
Предпочтительна полная эксцизионная биопсия. Образец должен иметь запас здоровой кожи толщиной 1–3 мм и включать все слои кожи и некоторое количество подкожного жира. Если предполагаемое поражение велико или расположено в косметически чувствительной области, может быть целесообразна инцизионная или пункционная биопсия. Образец инцизионной биопсии следует брать из наиболее аномальной области поражения. Бритвенную биопсию, как правило, не следует проводить, т.к. это может привести к неадекватному определению стадии и диагнозу. Бритвенная биопсия может быть приемлемой, когда вероятность диагноза меланомы низкая. Широкая бритвенная биопсия может быть оптимальной для гистологической оценки меланомы in situ.
Поскольку невыполнение повторного иссечения после биопсии меланомы связано с частотой местных рецидивов, достигающей 40%, рекомендуется выполнять повторное иссечение с определённым отступом от опухоли:
поражения in situ — отступ 0,5-1 см
поражения толщиной ≤ 1 мм — 1 см
поражения толщиной 1,01-2 мм — 1-2 см
поражения толщиной 2,01-4 мм — 2 см
поражения толщиной более 4 мм — не менее 2 см
Хотя ни один гистологический признак не является патогномоничным для меланомы, существует множество характерных особенностей. Практически всегда отмечается цитологическая атипия с увеличенными клетками, содержащими крупные плеоморфные гиперхромные ядра с выступающими ядрышками. Часто отмечаются многочисленные фигуры митоза.
Иммуногистохимическое окрашивание обычно не требуется для диагностики; они могут быть необходимы в случаях с неопределёнными результатами рутинной гистологии. Окраска как S-100, так и HMB45 даёт положительный результат в меланоцитах, причем последний демонстрирует более выражен в большинстве доброкачественных невусов, за исключением голубых невусов. S-100 и SOX-10 высокочувствительны, хотя и неспецифичны, к меланоцитам. Они особенно эффективны при плохо дифференцированных или веретенообразных опухолях.
PRAME (сокр. от англ. антиген, преимущественно экспрессируемый в меланоме) может окрашивать соединительный компонент доброкачественных невусов, но дермальное окрашивание указывает на меланому. Он не является полностью специфичным и окрашивает другие опухоли, включая опухоли яичка и клеточную нейротекеому. Этот маркёр помогает отличить остатки невуса от меланомы.
Mart-1/MelanA, а также MITF иногда используются для установления структуры меланоцитов, но все 3 могут окрашивать псевдогнёзда при лихеноидных тканевых реакциях. S100 часто слабо выражен в матриксе ногтя, и HMB-45 и Mart-1 могут иметь преимущество при ИГХ в этом месте. Секвенирование генов нового поколения и геномная гибридизация на микрочипах становятся обычным явлением для диагностики уникальных типов невусов и сложных меланоцитарных поражений. Анализы флуоресцентной гибридизации in situ (FISH) также находят новые применения, и широко используются молекулярные предикторы биологического ответа на таргетную иммунотерапию, причем наиболее частым является тестирование BRAF.
Пациентам с клинически увеличенными лимфатическими узлами и отсутствием признаков отдаленного метастазирования следует провести биопсию лимфатических узлов. В течение многих лет пациентам без клинически увеличенных узлов выполнялась лимфодиссекция. Однако исследования показывают, что у пациентов с меланомами толщиной 1-4 мм она может не дать значительного преимущества в выживаемости. Единственные пациенты, которым это приносит пользу, — это пациенты с очагами поражения толщиной 1,1–2 мм и моложе 60 лет.
Лимфатические сосуды из любого участка кожи стекают в один лимфатический узел. Этот узел называется сторожевым лимфатическим узлом и почти всегда является первым местом поражения при распространении меланомы на регионарные узлы.
Чтобы определить, какой узел является сторожевым, используются два метода (иногда в комбинации, которая позволяет обнаружить сторожевой узел в 98% случаев).
Первый метод предполагает введение синего красителя в место первичной меланомы. Второй метод включает введение радиоактивно меченного раствора в место первичного поражения и использование ручного гамма-детектора для определения местоположения сторожевого узла. Затем узел удаляется для патологической оценки. Биопсия сторожевого лимфатического узла (БСЛУ) даёт важную прогностическую, диагностическую и терапевтическую информацию. NCCN рекомендует обсуждать и предлагать БСЛУ пациентам со стадией IB или меланомой II стадии толщиной 0,76–1мм с изъязвлением или с частотой митоза ≥1/мм или толщиной >1мм. БСЛУ может предлагаться либо в качестве стандартного лечения, либо в рамках клинического исследования. NCCN не рекомендует БСЛУ пациентам с меланомой толщиной 0,75мм или менее. Доказательства, подтверждающие рутинную БСЛУ у пациентов с тонкими меланомами (Т1; толщина по Бреслоу <1 мм), отсутствуют, но это может быть применимо у отдельных пациентов с признаками высокого риска, у которых преимущества стадирования перевешивают риски процедуры.
Cadili и соавт. сообщили, что вероятность метастазирования в несторожевые лимфатические узлы можно предсказать на основании общего метастазирования в сторожевые лимфатические узлы. Их данные показали, что пациенты с метастазами размером ≥5 мм имеют 30% риск метастазирования. Напротив, у пациентов с общим размером метастазов в сторожевых лимфатических узлах менее 2 мм маловероятно (вероятность <3,67%) наличие метастаз в несторожевых узлах, и таким пациентам дополнительная диссекция лимфоузлов может оказаться невыгодной.
Биохимический анализ крови может предоставить данные о возможном метастатическом поражении. Например, повышенный уровень щелочной фосфатазы может сигнализировать о метастазах в кости или печень, тогда как повышенные уровни АЛТ и АСТ могут свидетельствовать о метастазах в печень. Общий белок и альбумин предоставляют информацию об общем состоянии здоровья и состоянии питания пациента. Многие схемы химиотерапии могут быть токсичными для почек, поэтому перед началом любого лечения необходимо измерить уровень креатинина. Уровень ЛДГ повышен при многих состояниях, включая многие злокачественные новообразования. Хотя повышение ЛДГ не является специфичным для меланомы, оно может быть полезным при последующем наблюдении за некоторыми пациентами с меланомой. Заметное повышение ЛДГ при постановке диагноза или при последующих визитах может указывать на отдалённые метастазы, особенно в лёгких и печени.
Хотя специфичность и чувствительность этого теста низкие, многочисленные исследования показывают, что повышенный уровень ЛДГ является независимым прогностическим фактором плохого прогноза. Уровень ЛДГ в настоящее время считается частью системы определения стадии меланомы.
Результаты рентгенограммы грудной клетки при постановке диагноза обеспечивают основу для дальнейшего сравнения. Пациентам со стадией III или местным рецидивом следует пройти рентгенографию грудной клетки или компьютерную томографию грудной клетки, поскольку лёгкие часто являются первым местом метастазирования.
Магнитно-резонансную томографию (МРТ) головного мозга следует проводить во время обследования пациента с известными отдалёнными метастазами для выявления дополнительных бессимптомных метастатических заболеваний. Это особенно актуально для пациентов, у которых рассматривается возможность лечения высокими дозами интерлейкина-2. МРТ головного мозга у пациентов без известного метастазирования следует проводить только тем, у кого есть неврологические симптомы.
ПЭТ-КТ в настоящее время является наиболее чувствительным инструментом диагностики метастатического заболевания. ПЭТ-КТ не показано на ранней стадии заболевания (стадия I или II), но может помочь определить стадию у пациентов с поражением лимфатических узлов или транзиторными или сателлитными поражениями. Многие исследования сообщают, что для выявления метастатического заболевания ПЭТ-КТ обладает большей чувствительностью, чем обычные рентгенографические исследования. ПЭТ-КТ полезно для оценки реакции метастатического заболевания на терапию.
Лечение
Хирургическое вмешательство является методом лечения меланомы на ранней стадии. У пациентов с одиночными метастазами в головной мозг или с острыми симптомами хирургическое лечение или лечение гамма-ножом может облегчить симптомы и обеспечить местный контроль над заболеванием. Поскольку окончательным лечением меланомы кожи является хирургическое вмешательство, медикаментозное лечение ограничивается адъювантной терапией пациентов с поздней стадией меланомы. Менее половины пациентов с толстыми первичными (>4мм) меланомами или поражением регионарных лимфатических узлов имеют долгосрочную безрецидивную выживаемость; следовательно, эти пациенты относятся к группе высокого риска и должны рассматриваться для назначения адъювантной терапии.
По стадиям стандартные варианты лечения меланомы следующие:
Стадия 0 — иссечение
Стадия I — иссечение с удалением лимфатических узлов или без него
Стадия II — иссечение с удалением лимфатических узлов или без него
Операбельная стадия III — иссечение с удалением или без удаления лимфатических узлов; адъювантная терапия и иммунотерапия
Неоперабельная стадия III, стадия IV и рецидивирующая меланома — внутриочаговая терапия, иммунотерапия, ингибиторы сигнальной трансдукции, химиотерапия, паллиативная местная терапия.
Важнейшим вопросом при выборе схемы лечения является наличие в опухоли мутации BRAF V600. Комбинации ингибиторов BRAF и BRAF/MEK полезны у некоторых пациентов для замедления прогрессирования заболевания.
У пациентов без мутации BRAF (т.е. BRAF дикого типа) текущие рекомендации NCCN предполагают монотерапию с использованием ингибитора программируемой гибели клеток-1 (PD-1) пембролизумаба или ниволумаба.
Пациентам с мутацией BRAF NCCN рекомендует таргетную комбинированную терапию дабрафенибом/траметинибом или вемурафенибом/кобиметинибом. Таргетная терапия предпочтительна, если она клинически необходима для раннего ответа. Современные таргетные методы лечения могут замедлить рост опухоли (например, ингибирование BRAF) или снять блок с иммунного ответа, что приводит к лизису опухоли (например, ингибирование PD-1).
При метастатическом или неоперабельном заболевании предпочтительными схемами NCCN являются следующие:
Комбинированная блокада контрольных точек ниволумабом плюс ипилимумабом или ниволумабом плюс релатлимаб-rmbw
Монотерапия анти-PD-1 пембролизумабом или ниволумабом
Комбинированная таргетная терапия
Для заболеваний с положительной мутацией BRAF V600 рекомендуемые схемы лечения следующие:
Дабрафениб/траметиниб
Вемурафениб/кобиметиниб
Энкорафениб/биниметиниб
Интерферон альфа-2b был одобрен в 1995 для адъювантного лечения после иссечения у пациентов, у которых нет заболевания, но имеют высокий риск рецидива. Однако, хотя было показано, что высокие дозы интерферона альфа-2b и пегилированного интерферона улучшают безрецидивную выживаемость, ни один из них не улучшает общую выживаемость. В настоящее время этот подход не предлагается пациентам, если нет противопоказаний к назначению ингибиторов PD-1 или комбинаций ингибиторов BRAF/MEK.
Неоадъювантная терапия резектабельной меланомы высокого риска продемонстрировала значительную эффективность в ранних клинических исследованиях. Неоадъювантная терапия чаще всего состоит из пембролизумаба или ниволумаба/ипилимумаба. Текущие рекомендации NCCN предполагают возможность неоадъювантной терапии, предпочтительно в контексте клинических исследований, у пациентов с выраженным резектабельным поражением лимфоузлов и в следующих случаях:
очень высокий риск рецидива после полной резекции;
высокий риск периоперационных осложнений из-за обширности резекции или сопутствующих заболеваний;
неопределенная вероятность достижения полной резекции узлового поражения.
Ряд практических руководств рекомендует селективную диссекцию лимфатических узлов для пациентов с положительной БСЛУ, но риск должен быть взвешен для каждого пациента. Не было доказано, что диссекция влияет на общую выживаемость, но помогает в региональном контроле над болезнями. Возможным вариантом является тщательное наблюдение с удалением увеличенных узлов. Второе многоцентровое исследование по селективной лимфаденэктомии (MSLT-II) подтвердило, что немедленная полная диссекция у пациентов с метастазами, обнаруженными при БСЛУ, увеличивает степень регионального контроля заболевания и предоставляет прогностическую информацию. Однако немедленная диссекция не увеличивала выживаемость, специфичную для меланомы.
Адъювантная терапия используется при местно-распространённой меланоме (стадия III), а в последнее время и при метастатической стадии заболевания. В настоящее время стандартом для меланомы II стадии является наблюдение, а не адъювантная терапия, этим пациентам рекомендуется участвовать в клинических исследованиях. Иммунная терапия и таргетная терапия (например, в случаях мутаций BRAF) предпочтительны для лечения неоперабельных или отдаленных метастатических заболеваний. Изолированная перфузия конечностей и внутриочаговая терапия талимогеном лагерпарепвеком (T-VEC) могут быть подходящими для некоторых пациентов с локализованными метастазами.
NCCN рекомендуют рассмотреть возможность лучевой терапии в следующих ситуациях:
Первичное заболевание: в качестве адъювантного лечения у отдельных пациентов с факторами, которые включают глубокую десмопластическую меланому с узкими краями, обширный нейротропизм или местно-рецидивирующее заболевание.
Регионарное заболевание: в качестве адъювантного лечения после резекции узлов категории 2В и ЛДГ <1,5 раза выше верхнего предела нормы и экстранодального распространения опухоли; в качестве паллиативного лечения неоперабельного заболевания.
Метастатическое заболевание: в качестве вспомогательного или основного лечения метастазов в головной мозг.
Краткие данные о лекарствах
Дакарбазин
Хотя механизм действия дакарбазина неизвестен, возможные действия включают алкилирующее действие, антиметаболит пурина или взаимодействие с сульфгидрильными группами. Конечным результатом является ингибирование ДНК, рибонуклеиновой кислоты (РНК) и синтеза белка.
Ипилимумаб
Представляет собой гуманизированное антитело, которое преодолевает опосредованную CTLA-4 супрессию Т-клеток и усиливает иммунный ответ против опухолей. Маркер CTLA-4 связан со стимулированием регуляторного ответа иммунной системы. Этот регуляторный ответ оказывает ослабляющее воздействие на иммунную систему.
Дабрафениб
Дабрафениб ингибирует некоторые мутированные формы киназ BRAF. Он показан в качестве монотерапии при неоперабельной или метастатической меланоме с мутацией BRAF V600E. Он показан в сочетании с траметинибом при неоперабельной или метастатической меланоме с положительной мутацией BRAF V600E или V600K. Кроме того, он одобрен для адъювантной терапии в сочетании с траметинибом при меланоме с мутациями BRAF V600E или V600K и поражением лимфатических узлов после полной резекции.
Траметиниб
Траметиниб — обратимый, высокоселективный, аллостерический ингибитор активации митогенактивируемых регулируемых внеклеточным сигналом киназы 1 (МЕК1) и 2 (МЕК2). Он показан в виде монотерапии или в комбинации с дабрафенибом при неоперабельной или метастатической меланоме с мутациями BRAF V600E или V600K. Кроме того, он одобрен для адъювантной терапии в сочетании с дабрафенибом при меланоме с мутациями BRAF V600E или V600K и поражением лимфатических узлов после полной резекции.
Пембролизумаб
Пембролизумаб представляет собой ингибитор белка программируемой клеточной гибели-1 (PD-1). Он показан в качестве лечения первой линии неоперабельной или метастатической меланомы. Он также показан для адъювантного лечения удаленной меланомы 3 стадии высокого риска.
Вемурафениб
Ингибирует некоторые мутированные формы серин-треониновой киназы BRAF, включая BRAF V600E. Препарат показан при неоперабельной или метастатической меланоме с мутацией BRAF V600. Вемурафениб не изучался при меланоме BRAF дикого типа.
Ниволумаб/релатлимаб
Комбинация с фиксированными дозами показана для лечения взрослых и детей в возрасте 12 лет и старше с неоперабельной или метастатической меланомой. Ниволумаб представляет собой антитело, блокирующее рецептор программируемой смерти-1 (PD-1), а релатлимаб представляет собой антитело, блокирующее ген активации лимфоцитов-3 (LAG-3). Комбинация приводит к большей активации Т-клеток, чем при использовании любого антитела по отдельности.
Ниволумаб
Ниволумаб представляет собой моноклональное антитело к белку запрограммированной гибели клеток-1 (PD-1). Он блокирует взаимодействие между PD-1 и его лигандами PD-L1 и PD-L2. Он показан в качестве монотерапии при неоперабельной или метастатической меланоме и прогрессировании заболевания после лечения ипилимумабом, а также в качестве ингибитора BRAF при положительной мутации BRAF V600. Он также показан в качестве монотерапии при лечении неоперабельной или метастатической меланомы дикого типа или мутационной меланомы BRAF V600. Комбинированная терапия с ипилимумабом для лечения пациентов с BRAF V600 дикого типа или неоперабельной или метастатической меланомой с положительной мутацией превосходит монотерапию любым препаратом.
Кобиметиниб
Обратимый ингибитор митоген-активируемой протеинкиназы (MAPK)/киназы 1, регулируемой внеклеточным сигналом (MEK1) и MEK2. Белки MEK являются вышестоящими регуляторами пути внеклеточной сигнальной киназы (ERK), который способствует клеточной пролиферации. Кобиметиниб показан при неоперабельной или метастатической меланоме у пациентов с мутацией BRAF V600E или V600K в сочетании с вемурафенибом. Кобиметиниб и вемурафениб воздействуют на две разные киназы пути RAS/RAF/MEK/ERK; по сравнению с любым препаратом в отдельности, совместное введение приводило к усилению апоптоза in vitro и снижению роста опухоли в исследованиях на мышах с имплантированными клетками, несущими мутации BRAF V600E.
Биниметиниб
Ингибирует митоген-активируемую киназу, регулируемую внеклеточным сигналом (MEK) 1 и MEK 2. Белки MEK являются вышестоящими регуляторами фосфорилирования, связанного с внеклеточной сигнальной киназой (ERK), и MEK-зависимого фосфорилирования BRAF-мутантных клеточных линий меланомы человека. Он показан в сочетании с энкорафенибом пациентам с неоперабельной или метастатической меланомой с мутацией BRAF V600E или V600K, обнаруженной с помощью теста, одобренного FDA.
Энкорафениб
Ингибитор киназы, нацеленный на BRAF V600E. Этот путь регулирует несколько ключевых клеточных процессов, включая пролиферацию, дифференцировку, выживание и ангиогенез. Было показано, что неадекваная активация белков этого пути происходит при многих видах рака, включая меланому. Он показан в сочетании с биниметинибом пациентам с неоперабельной или метастатической меланомой с мутацией BRAF V600E или V600K, обнаруженной с помощью теста, одобренного FDA.
Интерферон альфа 2b
ИФН альфа-2b представляет собой белковый продукт, полученный с помощью технологии рекомбинантной ДНК. Механизм противоопухолевой активности не совсем понятен; важная роль отводится прямым антипролиферативным эффектам против злокачественных клеток и модуляции иммунного ответа хозяина. Это препарат выбора для адъювантной терапии у пациентов с меланомой высокого риска. Его иммуномодулирующие эффекты включают подавление пролиферации опухолевых клеток, усиление фагоцитарной активности макрофагов и усиление цитотоксичности лимфоцитов.
Пегинтерферон альфа 2b
Пегинтерферон альфа-2b — иммуномодулирующий цитокин, усиливающий активность фагоцитов и лимфоцитов. Альфа-интерфероны действуют через высокоаффинные рецепторы клеточной поверхности, которые, как известно, после активации ингибируют клеточный рост, изменяют состояние клеточной дифференцировки, препятствуют экспрессии онкогенов, изменяют экспрессию антигенов клеточной поверхности, повышают фагоцитарную активность макрофагов и усиливают цитотоксичность лимфоцитов для клеток-мишеней. Ковалентное присоединение полимерных цепей полиэтиленгликоля к молекулам интерферона (известное как ПЭГилирование) может значительно увеличить время пребывания препарата в кровотоке, что, в свою очередь, может снизить частоту дозирования и потенциально снизить тяжесть и частоту побочных эффектов.
Интерлейкин 2
IL-2 — единственный известный метод лечения меланомы на поздних стадиях. Он активирует Т-клетки и усиливает их реакцию. Он усиливает противоопухолевую активность естественных клеток-киллеров.
Талимоген лагерпарепвек
Точный механизм действия неизвестен. Препарат представляет собой генетически модифицированный живой аттенуированный вирус простого герпеса, запрограммированный на репликацию в опухолях и выработку иммуностимулирующего белка GM-CSF. Вызывает лизис опухолей с последующим высвобождением опухолевых антигенов, которые вместе с ГМ-КСФ вирусного происхождения могут способствовать противоопухолевому иммунному ответу. Это раствор для внутриочаговой инъекции, который можно рассматривать для местного лечения неоперабельных кожных, подкожных и узловых поражений у пациентов с рецидивом меланомы после первичного хирургического вмешательства.
Тебентафусп
Биспецифический белок, состоящий из растворимого Т-клеточного рецептора, слитого с иммуноэффекторной функцией против CD3, который специфически нацелен на gp100, экспрессируемый в меланоцитах и меланоме.
Лифилеусель (Амтагви)
Это первая аутологичная Т-клеточная терапия, одобренная для лечения солидного рака. Он показан при неоперабельной или метастатической меланоме у взрослых, ранее получавших блокирующее антитело PD-1, а также при положительной мутации BRAF V600 — ингибитор BRAF с ингибитором MEK или без него.
Профилактика меланомы
Целью профилактики меланомы является избегание нахождения на солнце. Каждому, особенно людям с высоким риском развития меланомы, следует делать следующее: носите защитную одежду, избегайте самых жарких часов на солнце, защитите детей от воздействия ультрафиолета, избегайте соляриев, используйте солнцезащитный крем с фактором защиты от солнца (SPF) не менее 15.
В различных исследованиях польза солнцезащитного крема для предотвращения меланомы варьировалась от существенной до незаметной. Кроме того, более чем в одном исследовании сообщалось, что применявшие солнцезащитный крем чаще преднамеренно подвергаются воздействию солнца и чаще получают солнечные ожоги. Родственникам первой степени родства пациента с диагнозом семейной меланомы следует рекомендовать ежегодное обследование кожи. Лицам с другими факторами риска развития меланомы следует регулярно проходить обследование или проводить самообследование.
Примечание к материалу. Существует ряд международных и национальных организаций, выпускающих рекомендации по диагностике и лечению меланомы. Каждая из них имеет свою точку зрения, исходя из имеющихся данных, по вопросам, связанным с меланомой. Целью заметки не был охват и анализ всех имеющихся руководств и рекомендаций.
Список литературы
- [Guideline] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Melanoma: Cutaneous. NCCN. Version 1.2024 — February 12, 2024.
- Melanoma Treatment (PDQ®)–Health Professional Version. National Cancer Institute. January 31, 2023.
- Robert C, Ribas A, Wolchok JD, Hodi FS, Hamid O, Kefford R, et al. Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. Lancet. 2014 Jul 14.
- Weber JS, D’Angelo SP, Minor D, Hodi FS, Gutzmer R, Neyns B, et al. Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti-CTLA-4 treatment (CheckMate 037): a randomised, controlled, open-label, phase 3 trial. Lancet Oncol. 2015 Apr. 16(4):375-84.
- Tawbi HA, et al; RELATIVITY-047 Investigators. Relatlimab and Nivolumab versus Nivolumab in Untreated Advanced Melanoma. N Engl J Med. 2022 Jan 6. 386 (1):24-34.
- Chesney J, Lewis KD, Kluger H, Hamid O, Whitman E, Thomas S, et al. Efficacy and safety of lifileucel, a one-time autologous tumor-infiltrating lymphocyte (TIL) cell therapy, in patients with advanced melanoma after progression on immune checkpoint inhibitors and targeted therapies: pooled analysis of consecutive cohorts of the C-144-01 study. J Immunother Cancer. 2022 Dec. 10 (12).
- Carvajal RD, Antonescu CR, Wolchok JD, et al. KIT as a therapeutic target in metastatic melanoma. JAMA. 2011 Jun 8. 305(22):2327-34.
- Nassar KW, Tan AC. The mutational landscape of mucosal melanoma. Semin Cancer Biol. 2020 Apr. 61:139-148.
- [Guideline] Nenclares P, Ap Dafydd D, Bagwan I, Begg D, Kerawala C, King E, et al. Head and neck mucosal melanoma: The United Kingdom national guidelines. Eur J Cancer. 2020 Oct. 138:11-18.
- Dalvin LA, Damento GM, Yawn BP, Abbott BA, Hodge DO, Pulido JS. Parkinson Disease and Melanoma: Confirming and Reexamining an Association. Mayo Clin Proc. 2017 Jul. 92 (7):1070-1079.
- Cancer Facts & Figures 2024. American Cancer Society. Accessed: February 27, 2024.
- Adamson AS, Suarez EA, Welch HG. Estimating Overdiagnosis of Melanoma Using Trends Among Black and White Patients in the US. JAMA Dermatol. 2022 Mar 16.
- Ward WH, Farma JM. Cutaneous Melanoma: Etiology and Therapy. 2017 Dec 21.
- Cancer Stat Facts: Melanoma of the Skin. National Cancer Institute. Accessed: February 27, 2024.
- Scott AR, Stoltzfus KC, Tchelebi LT, Trifiletti DM, Lehrer EJ, Rao P, et al. Trends in Cancer Incidence in US Adolescents and Young Adults, 1973-2015. JAMA Netw Open. 2020 Dec 1. 3 (12):e2027738.
- Shaikh WR, Xiong M, Weinstock MA. The contribution of nodular subtype to melanoma mortality in the United States, 1978 to 2007. Arch Dermatol. 2012 Jan. 148(1):30-6.
- Mocellin S, Pasquali S, Riccardo Rossi C, Nitti D. Validation of the prognostic value of lymph node ratio in patients with cutaneous melanoma: A population-based study of 8,177 cases. Surgery. 2011 Jul. 150(1):83-90.
- Survival Rates for Melanoma Skin Cancer, by Stage. American Cancer Society. January 17, 2024.
- Brewer JD, Christenson LJ, Weaver AL, et al. Malignant melanoma in solid transplant recipients: collection of database cases and comparison with surveillance, epidemiology, and end results data for outcome analysis. Arch Dermatol. 2011 Jul. 147(7):790-6..
- Jethanamest D, Vila PM, Sikora AG, Morris LG. Predictors of survival in mucosal melanoma of the head and neck. Ann Surg Oncol. 2011 Oct. 18(10):2748-56.
- Sandru A, Voinea S, Panaitescu E, Blidaru A. Survival rates of patients with metastatic malignant melanoma. J Med Life. 2014 Oct-Dec. 7 (4):572-6.
- Kantor J, Kantor DE. Routine dermatologist-performed full-body skin examination and early melanoma detection. Arch Dermatol. 2009 Aug. 145(8):873-6.
- Sabel MS, Wong SL. Review of evidence-based support for pretreatment imaging in melanoma. J Natl Compr Canc Netw. 2009 Mar. 7(3):281-9.
- Xing Y, Bronstein Y, Ross MI, Askew RL, Lee JE, Gershenwald JE, et al. Contemporary diagnostic imaging modalities for the staging and surveillance of melanoma patients: a meta-analysis. J Natl Cancer Inst. 2011 Jan 19. 103(2):129-42.
- Hu J, Cai X, Lv JJ, Wan XC, Zeng XY, Feng ML, et al. PRAME Immunohistochemistry as an Adjunct for Differential Diagnosis in Acral Lentiginous Melanoma and Acral Nevi. Hum Pathol. 2021 Nov 17.
- Cesinaro AM, Piana S, Paganelli A, Pedroni G, Santandrea G, Maiorana A. PRAME expression in cellular neurothekeoma: A study of 11 cases. J Cutan Pathol. 2021 Nov 10.
- Ricci C, Franceschini T, Giunchi F, Grillini M, Ambrosi F, Massari F, et al. Immunohistochemical Expression of Preferentially Expressed Antigen in Melanoma (PRAME) in the Uninvolved Background Testis, Germ Cell Neoplasia in Situ, and Germ Cell Tumors of the Testis. Am J Clin Pathol. 2021 Dec 1.
- Farah M, Chung HJ. Diagnostic utility of preferentially expressed antigen in melanoma immunohistochemistry in the evaluation of melanomas with a co-existent nevoid melanocytic population: A single-center retrospective cohort study. J Am Acad Dermatol. 2021 Oct 28.
- Wilson ML. Histopathologic and Molecular Diagnosis of Melanoma. Clin Plast Surg. 2021 Oct. 48 (4):587-598.
- Revythis A, Shah S, Kutka M, Moschetta M, Ozturk MA, Pappas-Gogos G, et al. Unraveling the Wide Spectrum of Melanoma Biomarkers. Diagnostics (Basel). 2021 Jul 26. 11 (8).
- Rashid S, Tsao H. Recognition, Staging, and Management of Melanoma. Med Clin North Am. 2021 Jul. 105 (4):643-661.
- Deacon DC, Smith EA, Judson-Torres RL. Molecular Biomarkers for Melanoma Screening, Diagnosis and Prognosis: Current State and Future Prospects. Front Med (Lausanne). 2021. 8:642380.
- Bachter D, Michl C, Buchels H, Vogt H, Balda BR. The predictive value of the sentinel lymph node in malignant melanomas. Recent Results Cancer Res. 2001. 158:129-36.
- Cadili A, McKinnon G, Wright F, Hanna W, Macintosh E, Abhari Z, et al. Validation of a scoring system to predict non-sentinel lymph node metastasis in melanoma. J Surg Oncol. 2010 Mar 1. 101(3):191-4.
- McWilliams RR, Rao RD, Buckner JC, Link MJ, Markovic S, Brown PD. Melanoma-induced brain metastases. Expert Rev Anticancer Ther. 2008 May. 8(5):743-55.
- Faries MB, Thompson JF, Cochran AJ, Andtbacka RH, Mozzillo N, et al. Completion Dissection or Observation for Sentinel-Node Metastasis in Melanoma. N Engl J Med. 2017 Jun 8. 376 (23):2211-2222.
- Leiter U, Stadler R, Mauch C, et al. Survival of SLNB-positive melanoma patients with and without complete lymph node dissection: A multicenter, randomized DECOG trial. Journal of Clinical Oncology. 2015. 33 (suppl):Abstract LBA9002.
- Saberian C, Sperduto P, Davies MA. Targeted therapy strategies for melanoma brain metastasis. Neurooncol Adv. 2021 Nov. 3 (Suppl 5):v75-v85.
- Khaddour K, Maahs L, Avila-Rodriguez AM, Maamar Y, Samaan S, Ansstas G. Melanoma Targeted Therapies beyond BRAF-Mutant Melanoma: Potential Druggable Mutations and Novel Treatment Approaches. Cancers (Basel). 2021 Nov 22. 13 (22).
- Ferrucci PF, Lens M, Cocorocchio E. Combined BRAF-Targeted Therapy with Immunotherapy in BRAF-Mutated Advanced Melanoma Patients. Curr Oncol Rep. 2021 Nov 4. 23 (12):138.
- Aleksakhina SN, Imyanitov EN. Cancer Therapy Guided by Mutation Tests: Current Status and Perspectives. Int J Mol Sci. 2021 Oct 10. 22 (20).
- Teixido C, Castillo P, Martinez-Vila C, Arance A, Alos L. Molecular Markers and Targets in Melanoma. Cells. 2021 Sep 5. 10 (9).
- Carlino MS, Larkin J, Long GV. Immune checkpoint inhibitors in melanoma. Lancet. 2021 Sep 11. 398 (10304):1002-1014.
- Sevilla-Ortega L, Ferrándiz-Pulido L, Palazón-Carrión N, et al. Role of Isolated Limb Perfusion in the Era of Targeted Therapies and Immunotherapy in Melanoma. A Systematic Review of The Literature. Cancers (Basel). 2021 Oct 31. 13 (21).
- Soldozy S, Mulligan KM, Zheng DX, Levoska MA, Cullison CR, Elarjani T, et al. Oncolytic Virotherapy for Melanoma Brain Metastases, a Potential New Treatment Paradigm?. Brain Sci. 2021 Sep 23. 11 (10).
- Carr MJ, Sun J, DePalo D, Rothermel LD, Song Y, Straker RJ, et al. Talimogene Laherparepvec (T-VEC) for the Treatment of Advanced Locoregional Melanoma After Failure of Immunotherapy: An International Multi-Institutional Experience. Ann Surg Oncol. 2021 Oct 14.
- Zawit M, Swami U, Awada H, Arnouk J, Milhem M, Zakharia Y. Current status of intralesional agents in treatment of malignant melanoma. Ann Transl Med. 2021 Jun. 9 (12):1038.
- Long GV, Hauschild A, Santinami M, Atkinson V, Mandalà M, Chiarion-Sileni V, et al. Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma. N Engl J Med. 2017 Nov 9. 377 (19):1813-1823.
- Hauschild A, Dummer R, Santinami M, et al. Long-term benefit of adjuvant dabrafenib + trametinib (D+T) in patients (pts) with resected stage III BRAF V600–mutant melanoma: Five-year analysis of COMBI-AD. J Clin Oncol. 2020. 38:15.
- Eggermont AMM, Blank CU, Mandala M, Long GV, Atkinson V, Dalle S, et al. Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma. N Engl J Med. 2018 May 10. 378 (19):1789-1801.
- Eggermont AM, Blank CU, Mandalà M, et al. Pembrolizumab versus placebo after complete resection of high-risk stage III melanoma: New recurrence-free survival results from the EORTC 1325-MG/Keynote 054 double-blinded phase III trial at three-year median follow-up. J Clin Oncol. 2020. 38:15.
- Andtbacka RH, Kaufman HL, Collichio F, Amatruda T, Senzer N, Chesney J, et al. Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma. J Clin Oncol. 2015 Sep 1. 33 (25):2780-8.
- Eggermont AM, Suciu S, Testori A, et al. Ulceration and stage are predictive of interferon efficacy in melanoma: results of the phase III adjuvant trials EORTC 18952 and EORTC 18991. Eur J Cancer. 2012 Jan. 48(2):218-25.
- Lazarus HM, Ragsdale CE, Gale RP, Lyman GH. Sargramostim (rhu GM-CSF) as Cancer Therapy (Systematic Review) and An Immunomodulator. A Drug Before Its Time?. Front Immunol. 2021. 12:706186.
- Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Five-Year Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med. 2019 Oct 17. 381 (16):1535-1546.
- Ascierto PA, McArthur GA, Dréno B, Atkinson V, Liszkay G, Di Giacomo AM, et al. Cobimetinib combined with vemurafenib in advanced BRAF(V600)-mutant melanoma (coBRIM): updated efficacy results from a randomised, double-blind, phase 3 trial. Lancet Oncol. 2016 Sep. 17 (9):1248-60.
- Dummer R, Ascierto PA, Gogas HJ, Arance A, Mandala M, Liszkay G, et al. Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2018 May. 19 (5):603-615.
- Gutzmer R, Stroyakovskiy D, Gogas H, Robert C, Lewis K, Protsenko S, et al. Atezolizumab, vemurafenib, and cobimetinib as first-line treatment for unresectable advanced BRAFV600 mutation-positive melanoma (IMspire150): primary analysis of the randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2020 Jun 13. 395 (10240):1835-1844.
- Wolchok JD, Chiarion-Sileni V, Gonzalez R, et al. Long-Term Outcomes With Nivolumab Plus Ipilimumab or Nivolumab Alone Versus Ipilimumab in Patients With Advanced Melanoma. J Clin Oncol. 2022 Jan 10. 40 (2):127-137.
- Hodi FS, Corless CL, Giobbie-Hurder A, et al. Imatinib for melanomas harboring mutationally activated or amplified KIT arising on mucosal, acral, and chronically sun-damaged skin. J Clin Oncol. 2013 Jul 8.
- Hirai I, Tanese K, Fukuda K, Fusumae T, Nakamura Y, Sato Y, et al. Imatinib mesylate in combination with pembrolizumab in patients with advanced KIT-mutant melanoma following progression on standard therapy: A phase I/II trial and study protocol. Medicine (Baltimore). 2021 Dec 10. 100 (49):e27832.
- Ellingsen EB, Bjørheim J, Gaudernack G. Therapeutic cancer vaccination against telomerase: clinical developments in melanoma. Curr Opin Oncol. 2023 Jan 17.
- Tobin RP, Cogswell DT, Cates VM, Davis DM, Borgers JSW, Van Gulick RJ, et al. Targeting MDSC differentiation using ATRA: a phase I/II clinical trial combining pembrolizumab and all-trans retinoic acid for metastatic melanoma. Clin Cancer Res. 2022 Nov 15.
- Martinez-Perez D, Viñal D, Solares I, Espinosa E, Feliu J. Gp-100 as a Novel Therapeutic Target in Uveal Melanoma. Cancers (Basel). 2021 Nov 27. 13 (23).
- Ghiasvand R, Weiderpass E, Green AC, Lund E, Veierød MB. Sunscreen Use and Subsequent Melanoma Risk: A Population-Based Cohort Study. J Clin Oncol. 2016 Nov 20. 34 (33):3976-3983.
- Wehner MR. Sunscreen and melanoma prevention: evidence and expectations. Br J Dermatol. 2018 Jan. 178 (1):15-16.
- Silva ESD, Tavares R, Paulitsch FDS, Zhang L. Use of sunscreen and risk of melanoma and non-melanoma skin cancer: a systematic review and meta-analysis. Eur J Dermatol. 2018 Apr 1. 28 (2):186-201.
- US Preventive Services Task Force, Mangione CM, Barry MJ, Nicholson WK, Chelmow D, Coker TR, et al. Screening for Skin Cancer: US Preventive Services Task Force Recommendation Statement. JAMA. 2023 Apr 18. 329 (15):1290-1295.
- [Guideline] Michielin O, van Akkooi ACJ, Ascierto PA, Dummer R, Keilholz U, ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 2019 Dec 1. 30 (12):1884-1901.
- [Guideline] Garbe C, et al; European Dermatology Forum (EDF), the European Association of Dermato-Oncology (EADO), and the European Organization for Research and Treatment of Cancer (EORTC). European consensus-based interdisciplinary guideline for melanoma. Part 1: Diagnostics — Update 2019. Eur J Cancer. 2020 Jan 9.