Введение
Кератоакантома (КА) — относительно распространённая опухоль низкой степени злокачественности, которая возникает в сальноволосяном юните и очень напоминает плоскоклеточный рак.
Хотя она была описана в 1888 Джонатаном Гетчинсоном, до сих пор многие вопросы эпидемиологии, гистопатологии, прогноза и лечения остаются спорными. Такие названия КА, как «сальный моллюск», «псевдоопухоль», «регрессирующая опухоль» и
«самоизлечивающийся плоскоклеточный рак», отражают имеющиеся спорные вопросы. Большинство из гипотез отводят место КА на границе добро- и злокачественных опухолей. По ряду классификаций кератоакантома относится к плоскоклеточному раку (ПКР). Но ряд исследователей выступают за различие между КА и ПКР на основе экспрессии генов или кожных маркеров.
Опухоль характеризуется быстрым ростом в течение нескольких недель или месяцев с последующим спонтанным разрешением обычно в течение 4-6 месяцев. КА редко прогрессирует до инвазивной или метастатической карциномы. Зачастую сложно оценить, являлась ли удалённая опухоль ПКР или КА, из-за отсутствия чётких классификационных критериев.
Этиология
Точная причина КА остается неясной; однако следует учитывать несколько потенциирующих факторов полученных в ходе эпидемиологических исследований: ультрафиолет, возраст, пол и анатомическая локализация.
Установлено, что промышленные рабочие, подвергающиеся воздействию смолы и дёгтя, чаще страдают КА, а также ПКР. Кроме того, исследование 2006 года показало тесную связь между курением сигарет и развитием КА.
Травма (ятрогенная или неятрогенная), вирус папилломы человека (в частности, типы 9, 11, 13, 16, 18, 24, 25, 33, 37 и 57), генетические факторы и ослабленный иммунитет также могут быть причинными факторами.
Полиомавирус клеток Меркеля не играет патогенной роли при кератоакантоме. У 20% пациентов с метастатической меланомой, которые лечились вемурафенибом, ингибитором BRAF V600E, наблюдалось развитие эруптивной КА или ПРК.
Исследования показали, что до трети КА имеют хромосомные аберрации. КА связана с такими синдромами, как синдром Мьюира-Торре, синдром Фергюсона-Смита, пигментная ксеродерма и недержание пигмента. При множественных КА типа Фергюсон-Смит описаны специфические мутации в рецепторе трансформирующего ростового фактора бета-1.
Патофизиология
По последним данным в отличие от обычного ПКР КА берёт начало из волосяного фолликула. Данная концепция предполагает, что КА представляет собой доброкачественный аналог фолликулярного ПКР (в отличие от обычного ПКР). В КА находят маркеры, которые совпадают с таковыми в устье фолликула и его верхней трети. Трёхфазное изменение КА: пролиферация (ранняя стадия), стабилизация (стадия полного развития) и регрессия – напоминает концепцию циклического развития волоса. У мышей с КА, вызванной химическими канцерогенами, регрессия КА не зависела от иммунной системы, но зависела от сигнальной системы Wnt/ретиноевая кислота, что поддерживает эту гипотезу.
Роль иммунной системы в появлении и исчезновении опухоли хоть и предполагается, но вызывает споры.
Важные сигнальные пути, предположительно участвующие в патогенезе КА – BRAF, HRAS, Hedgehog и p27. Внедрение в практику лечение ингибиторами BRAF при меланоме и ингибиторами пути Hedgehog при распространённой базальноклеточной карциноме вызвало всплеск заболеваемости КА.
Эпидемиология
Исследование заболеваемости КА среди белого населения США, проведённое на Гавайях, выявило 106 случаев на 100 000 человек. В этом исследовании сообщалось о частоте встречаемости КА, равной заболеваемости ПКР, и подвергалось сомнению общепринятое соотношение 1:3. Пик заболеваемости приходится на седьмое десятилетие или позже.
Исследования частоты кератоакантомы у этнических японцев, филиппинцев и гавайцев показали 22, 7 и 6 случаев на 100 000 населения соответственно. В других исследованиях в разных географических точках исследованиях соотношение КА и ПКР варьировало от 1:0,6 до 1:5 .
КА реже встречается у темнокожих людей. Соотношение мужчин и женщин составляет 2:1. Кератоакантома встречается во всех возрастных группах, но заболеваемость увеличивается с возрастом. Она редко встречается у лиц моложе 20 лет.
Клиническая картина
Солитарная (одиночная) КА — самый частый вариант КА. Она обычно растёт быстро, достигая 1-2 см в течение нескольких недель, после чего следует период медленной инволюции, продолжающийся до 1 года. Поражения обычно одиночные и начинаются с плотных, округлых, телесного или красноватого цвета папул, которые прогрессируют в куполообразные узелки с гладкой блестящей поверхностью и центральным кратерообразным изъязвлением или кератиновой пробкой, которая может выступать в виде рога.
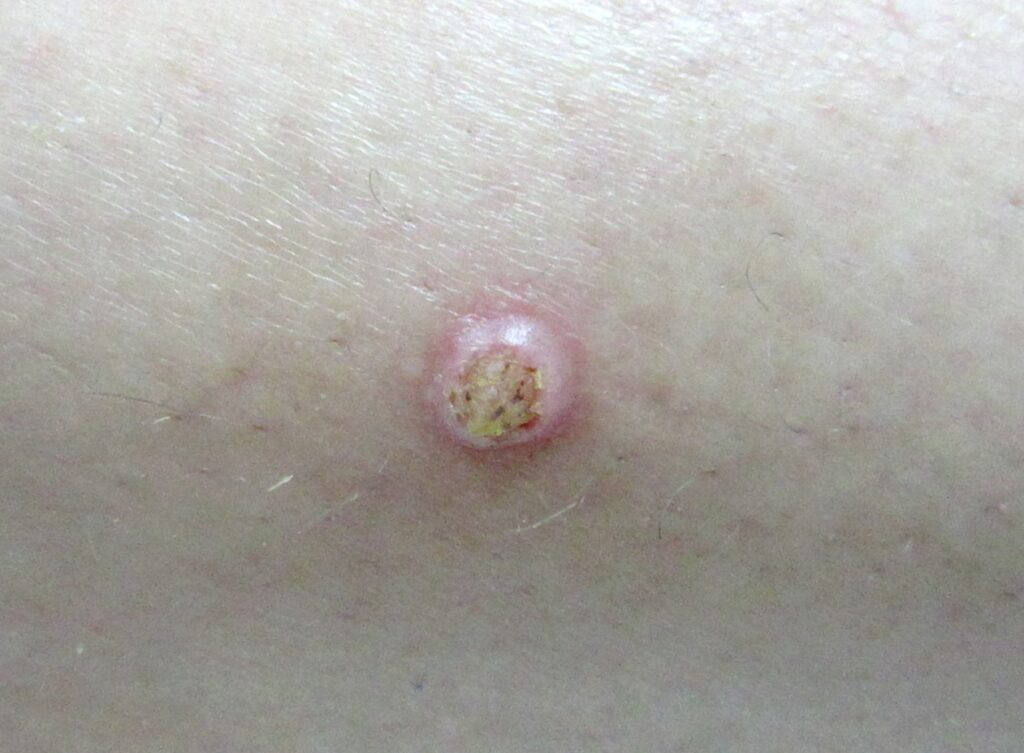
Большинство КА возникает на участках, подверженных воздействию солнечных лучей: лицо, шея и тыльная поверхность верхних конечностей. Поражения туловища встречаются редко. Солитарная КА может локализоваться на слизистых, преимущественно ротовой полости, но иногда возникает на конъюнктиве глаз и на вульве. Редкой и сложной для диагностики и лечения локализацией является подногтевая КА.
Краевая центробежная КА: этот вариант характеризуется прогрессивным периферическим ростом и конечным размером 5-30 см.
Существуют разновидности КА в виде самостоятельных синдромов или как составная часть. Эруптивная кератоакантома Гжибовского: характеризуется генерализованной сыпью из многочисленных куполообразных папул телесного цвета диаметром 2–7 мм. Также могут появиться множественные типичные кератоакантомы большего размера. Сыпь обычно не затрагивает ладони и подошвы. Характерной чертой может быть сильный зуд. Папулёзные поражения обычно не инволютируют.
Множественная КА Фергюсона-Смита: это редкий аутосомно-доминантный тип самоизлечивающейся кератоакантомы, поражения которого возникают в раннем взрослом возрасте.
КА может быть компонентом синдрома Мюира-Торре, который представляет собой онкологический генодерматоз с множественными новообразованиями сальных желез (аденомы, эпителиомы, карциномы), КА и злокачественными новообразованиями желудочно-кишечного тракта (чаще всего толстой кишки). В случае выявления синдрома Мюира-Торре показано соответствующее возрасту обследование на рак.
Дифференциальный диагноз
Старческий кератоз, кожный рог, плоскоклеточный рак кожи, веррукозная карцинома, контагиозный моллюск, узловая почесуха, карцинома Меркеля, споротрихоз.
Диагностика
Одним из компонентов установления диагноза является гистопатологическое исследование тканей. Результаты биопсии КА нередко неотличимы от инвазивного ПКР; поэтому предпочтительна эксцизионная или глубокая инцизионная биопсия поражения.
КА состоят из исключительно хорошо дифференцированного плоского эпителия, который демонстрирует лишь лёгкую степень плеоморфизма и, вероятно, образует массы кератина, которые составляют центральную часть.
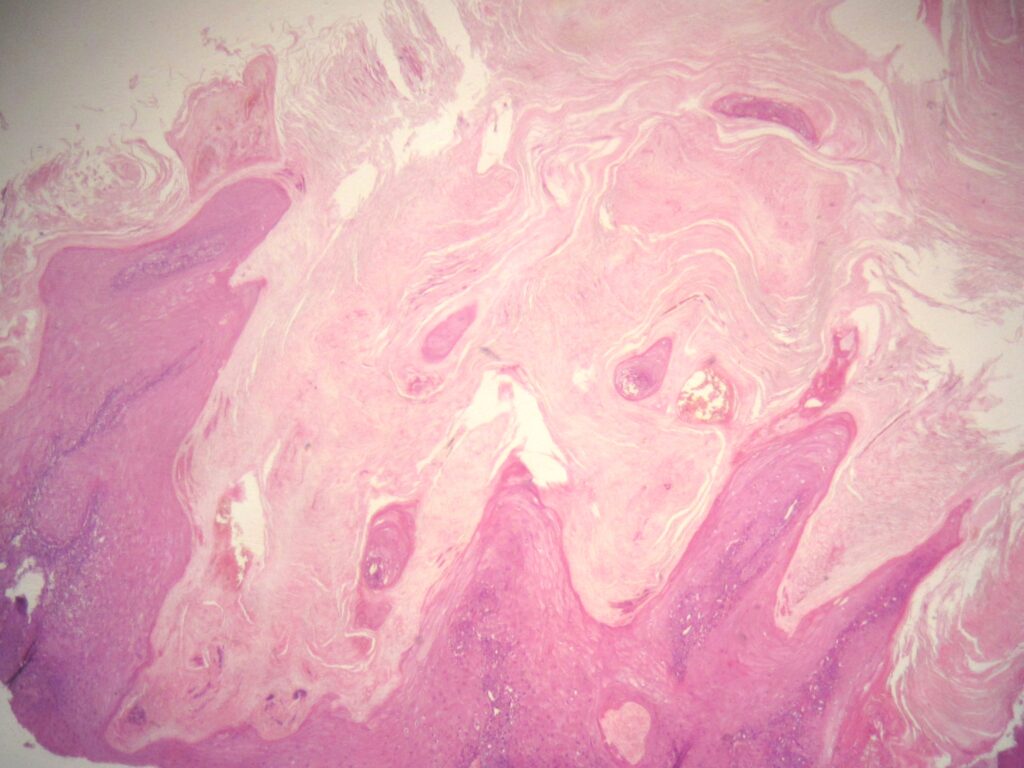
Псевдокарциноматозная инфильтрация при КА обычно представляет собой гладкую, правильную, чётко очерченную переднюю часть, не выходящую за пределы уровня потовых желез.
Существует ряд критериев для отличия ПКР от КА, но ни один из них не является однозначно достоверным. Отличия заключаются в симметрии, чёткой границе между опухолью и стромой, изъязвлении, митозах, плеоморфизме, дискератозе, интраэпителиальных эластических волокнах, заполненном кератином «кратере», паракератозе, акантолизе, периневральной инвазии и др. Некоторые патологи предпочитают термин «ПКР, тип кератоакантомы» или «вероятно КА; ПКР не может быть исключен». Для различий КА от ПКР могут быть использованы различные иммуногистохимические окрашивания с применением тканевых маркеров (IL-27, CD163, CD3+FoxP3+, BDCA2, Bcl-2, p53, Desmoglein 1 и 2, и др.). К сожалению, большое количество используемых потенциально специфических маркеров доказывают тот факт, что качественного среди них нет.
Гистопатология необходима для исключения других болезней, характеризующихся кратерообразными папулами или узлами (беспигментная меланома, первичная кожная лимфома, экзофитная пиломатриксома, криптококкоз, споротрихоз, туберкулёз кожи, дискоидная красная волчанка и др.) и может различить варианты ПКР, особенно фолликулярный ПКР, которой может мимикрировать под КА.
Лечение
Сохраняются споры о лечении солитарной КА. Выжидательная стратегия при солитарной КА, которая предполагает спонтанную регрессию, сомнительна, пока нет очевидных признаков инволюции. При этом подходе нельзя предсказать окончательный размер КА, который может достигать нескольких см до начала регресса, и нельзя быть уверенным в бесследном заживлении кожи. Возможная трансформация в инвазивный ПКР с метастазами крайне мала, тем не менее это стоит принимать во внимание при выборе лечения.
Лечение КА преимущественно хирургическое. Иное лечение применяется в тех случаях, когда хирургическое вмешательство либо невозможно, либо желательно. Опухоль обычно иссекают с отступом 3-5 мм. В случае удаления опухоли путём бритвенной биопсии полученного материала может быть недостаточно для того, чтобы отличить КА от инвазивного ПКР. Поскольку биологическое поведение отдельной КА невозможно предсказать, многие считают адекватным хирургическое лечение эквивалентное лечению ПКР.
Второй линией лечения КА является внутриочаговое введение лекарственных препаратов. Наиболее предпочтительным лекарственным режимом считается метотрексат и 5-фторурацил, иногда с добавлением блеомицина или интерфеонов. Метотрексат обычно требует 2 или более инъекций для достижения ремиссии. Внутриочаговая химиотерапия может предшествовать хирургическому лечению для уменьшения размера опухоли на 50-80%. 2-шаговый режим предпочтителен для лучших косметических и функциональных результатов, чем одни только внутриочаговые инъекции. Другие терапевтические подходы – лазеры, криотерапия, радиотерапия, ФДТ, 5-ФУ, имиквимод, подофиллин, эрлотиниб, системные ретиноиды.
Эти подходы могут быть целесообразными у пациентов с множественными поражениями, при поражениях, которые не поддаются хирургическому вмешательству из-за размера или местоположения, а также у пациентов с сопутствующими заболеваниями, которые препятствуют хирургическому вмешательству.
Системное лечение ацитретином или другими ретиноидами – 1-ая линия терапии множественных КА, как в виде монотерапии, так и в сочетании с хирургией или лекарственными подходами при одиночных КА. В начале лечения дозировка варьирует от 0,5 до 1 мг/кг ацитретина и может быть уменьшена при необходимости. При этом, несмотря на хороший ответ, полное избавление от КА довольно трудно достижимо. Для поддержания клинического ответа часто необходимы малые дозы ацитретина (10-20 мг в день) или повторные курсы лечения. Резистентные к лечению КА (особенно при типе Гржебовски) требуют других подходов. Сообщения об использовании таких системных цитостатиков, как метотрексат или 5-фторурацил, единичны. В отличие от внутриочагового введения метотрексата эффективность системного введения менее предсказуема. Было показано, что циклофосфамид с пульсовой дозой 1 г в месяц с целью уменьшения кумулятивной дозы и риска долгосрочной токсичности — эффективное средство при ретиноид- и метотрексат устойчивых случаях множественных КА. Эрлотиниб — ингибитор эпидермального фактора роста — новый обещающий подход для устойчивых КА, но опыт его применения пока ограничен. При генерализованных эруптивных КА тип Гржебовски внутриочаговое введение кортикостероидов иногда давало хороший ответ (как в виде монотерапия, так и вместе с системными ретиноидами). Некоторые исследователи также предлагают добавлять к системному лечению циклоспорин.
КА радиочувствительны и хорошо реагируют на низкие дозы радиации (<10 Гр). Лучевая терапия может быть полезна для отдельных пациентов с большими опухолями, у которых резекция приведет к деформации тканей, или при опухолях, которые рецидивировали после попытки иссечения.
Прогноз
Прогноз КА после эксцизионного удаления благоприятный. Рецидивирующие опухоли могут потребовать более агрессивной терапии. Рекомендуется наблюдение за пациентами на предмет развития нового первичного рака кожи. КА редко проявляются множественными опухолями, достигают размеров больше 5 см, становятся локально агрессивными и метастазируют.
Список литературы
- Gleich T, Chiticariu E, Huber M, Hohl D. Keratoacanthoma: A distinct entity?. Exp Dermatol. 2015 Oct 17.
- Gibbons M, Ernst A, Patel A, Armbrecht E, Behshad R. Keratoacanthomas: A review of excised specimens. J Am Acad Dermatol. 2019 Jun. 80 (6):1794-1796.
- Ra SH, Su A, Li X, Zhou J, Cochran AJ, Kulkarni RP, et al. Keratoacanthoma and squamous cell carcinoma are distinct from a molecular perspective. Mod Pathol. 2015 Jun. 28(6):799-806.
- Magalhaes RF, Cruvinel GT, Cintra GF, Cintra ML, Ismael AP, de Moraes AM. Diagnosis and follow-up of keratoacanthoma-like lesions: clinical-histologic study of 43 cases. J Cutan Med Surg. 2008 Jul-Aug. 12(4):163-73.
- Kossard S, Tan KB, Choy C. Keratoacanthoma and infundibulocystic squamous cell carcinoma. Am J Dermatopathol. 2008 Apr. 30(2):127-34.
- Cribier B, Asch P, Grosshans E. Differentiating squamous cell carcinoma from keratoacanthoma using histopathological criteria. Is it possible? A study of 296 cases. Dermatology. 1999. 199(3):208-12.
- Macdonald JB, Macdonald B, Golitz LE, LoRusso P, Sekulic A. Cutaneous adverse effects of targeted therapies: Part II: Inhibitors of intracellular molecular signaling pathways. J Am Acad Dermatol. 2015 Feb. 72 (2):221-36; quiz 237-8.
- Chuang TY, Reizner GT, Elpern DJ, Stone JL, Farmer ER. Keratoacanthoma in Kauai, Hawaii. The first documented incidence in a defined population. Arch Dermatol. 1993 Mar. 129(3):317-9.
- Chuang TY, Reizner GT, Elpern DJ, Stone JL, Farmer ER. Squamous cell carcinoma in Kauai, Hawaii. Int J Dermatol. 1995 Jun. 34(6):393-7.
- Letzel S, Drexler H. Occupationally related tumors in tar refinery workers. J Am Acad Dermatol. 1998 Nov. 39(5 Pt 1):712-20.
- Miot HA, Miot LD, da Costa AL, Matsuo CY, Stolf HO, Marques ME. Association between solitary keratoacanthoma and cigarette smoking: a case-control study. Dermatol Online J. 2006 Feb 28. 12(2):2.
- Hsi ED, Svoboda-Newman SM, Stern RA, Nickoloff BJ, Frank TS. Detection of human papillomavirus DNA in keratoacanthomas by polymerase chain reaction. Am J Dermatopathol. 1997 Feb. 19(1):10-5.
- Wieland U, Scola N, Stolte B, Stucker M, Silling S, Kreuter A. No evidence for a causal role of Merkel cell polyomavirus in keratoacanthoma. J Am Acad Dermatol. 2012 Jul. 67(1):41-6.
- Cabibi D, Conway de Macario E, Ingrao S, Porcasi R, Zucco F, Macario AJ, et al. CD1A-positive cells and HSP60 (HSPD1) levels in keratoacanthoma and squamous cell carcinoma. Cell Stress Chaperones. 2015 Oct 6.
- Sanders S, Busam KJ, Halpern AC, Nehal KS. Intralesional corticosteroid treatment of multiple eruptive keratoacanthomas: case report and review of a controversial therapy. Dermatol Surg. 2002 Oct. 28(10):954-8.
- Meffert JJ. Cutaneous sporotrichosis presenting as a keratoacanthoma. Cutis. 1998 Jul. 62(1):37-9.
- Patel NP, Cervino AL. Treatment of keratoacanthoma: Is intralesional methotrexate an option?. Can J Plastic Surg. Summer 2011. (19)2:e15-8.
- Canas GC, Robson KJ, Arpey CJ. Persistent keratoacanthoma: challenges in management. Dermatol Surg. 1998 Dec. 24(12):1364-9.