Введение
Кожная мигрирующая личинка (КМЛ) наиболее частая тропическая приобретённая кожная болезнь, которая была описана более 100 лет назад. КМЛ проявляется красными, изогнутыми, зудящими кожным высыпаниями, вызванные случайным попаданием в кожу и дальнейшей миграцией личинки нематоды. КМЛ чаще всего встречается в тропических и субтропических областях и на юго-западе США. Это заболевание характерно для Карибского региона, Центральной и Южной Америки, Африки и Юго-Восточной Азии. Но доступность международного транспорта приводит к тому, что КМЛ не ограничивается только этими географическими регионами.
Этиология
Самыми частыми причинами КМЛ являются:
· Ancylostoma braziliense (анкилостома диких и домашних кошек и собак), наиболее частая причина, встречается в центральных и южных штатах США, в центральной и южной Америках и Карибском регионе
· Ancylostoma caninum (анкилостома собак) встречается в Австралии
· Uncinaria stenocephala (анкилостома собак) встречается в Европе
· Bunostomum phlebotomum (анкилостома крупного рогатого скота)
Патофизиология
При КМЛ цикл развития паразита начинается с попадания яиц паразитов с фекалиями животных в тёплые, влажные, песчаные почвы, где личинки начинают своё развитие. Личинки изначально питаются почвенными бактериями и несколько раз линяют, прежде чем достигают 3-ей заразной стадии. Используя свои протеазы, личинки проникают через волосяные фолликулы, трещины или даже неповреждённую кожу в нового хозяина. После проникновения в роговой слой личинки сбрасывают свою естественную кутикулу. Обычно они начинают миграцию через несколько дней.
В своих естественных хозяевах личинки способны проникать в дерму и распространяться через лимфатические и венозные сосуды в лёгкие. После проникновения в альвеолы лёгких, личинки продвигаются в трахею и затем проглатываются. В кишечнике личинки достигают половой зрелости, производят яйца, которые выделяются в окружающую среду.
Человек является случайным хозяином и личинки из-за недостатка коллагеназы не могут проникнуть через базальную мембрану и проникнуть в дерму. Поэтому КМЛ остаётся только в эпидермисе инфицированного человека. Зудящие проявления являются следствием иммунного ответа на личинку и продукты её жизнедеятельности.
Эпидемиология
КМЛ располагается на 2-ом месте после острицы среди гельминтов в развивающихся странах. Частота КЛМ высока в регионах с тёплым климатом, где люди более склонны ходить босиком (на пляже, в низких социально-экономических слоях общества) и находятся в контакте с фекалиями животных. Половых, расовых различий нет. Дети чуть чаще болеют КМЛ.
Клиническая картина
Данные анамнеза могут включать в себя: покалывание в течение 30 минут в области проникновения личинок; сильный зуд; эритематозные, часто линейные, прогрессирующией поражения; контакт кожи с влажной почвой или песком, например, ходьба босиком по пляжу.
Предрасположенность к заражению КМЛ включает в себя: хобби и занятия, связанные с контактом с тёплой, влажной, песчаной почвой; путешествие в тропический/субтропический климат; нахождение детей в песочницах; определённые профессии (плотник, электрик, водопроводчик, фермер, садовник).
Кожные признаки КМЛ включают в себя зудящие, эритематозные, отёчные папулы и/или везикулы; серпигинозные, слегка приподнятые, эритематозные ходы шириной 2–3 мм, расположенные на расстоянии 3–4 см от места проникновения; неспецифический дерматит; везикулы с серозной жидкостью; вторичная импетигинизация; удлинение хода на 1-2 см/день.

Системные признаки наблюдаются редко, но могут включать периферическую эозинофилию (синдром Лёффлера), мигрирующие лёгочные инфильтраты и повышение уровня иммуноглобулина Е (IgE).
Поражения обычно располагаются на дистальных частях нижних конечностей, включая тыльную поверхность стоп и межпальцевые промежутки пальцев ног, но могут также возникать в аногенитальной области, ягодицах, кистях рук и коленях. Вторичная бактериальная инфекция у пациентов с КМЛ, обычно вызванная S. pyogenes, может привести к целлюлиту.
Дифференциальный диагноз
Аллергический и простой контактный дерматит, церкариальный дерматит, импетиго, чесотка, микоз кожи и микоз стоп.
Лабораторные исследования
У некоторых пациентов наблюдается периферическая эозинофилия в общем анализе крови и повышенный уровень общего IgE.
Биопсия кожи не требуется для диагностики КМЛ. Но в случае её выполнения необходимо брать образец кожи на 1–2 см впереди переднего края хода, иначе личинка может быть пропущена. Биопсия может подтвердить наличие личинок чуть выше дермоэпидермального соединения или в поверхностном эпидермисе. В окружающем эпидермисе обнаруживают спонгиоз, внутриэпидермальные везикуляции со смешанным воспалительным инфильтратом и эозинофилами.
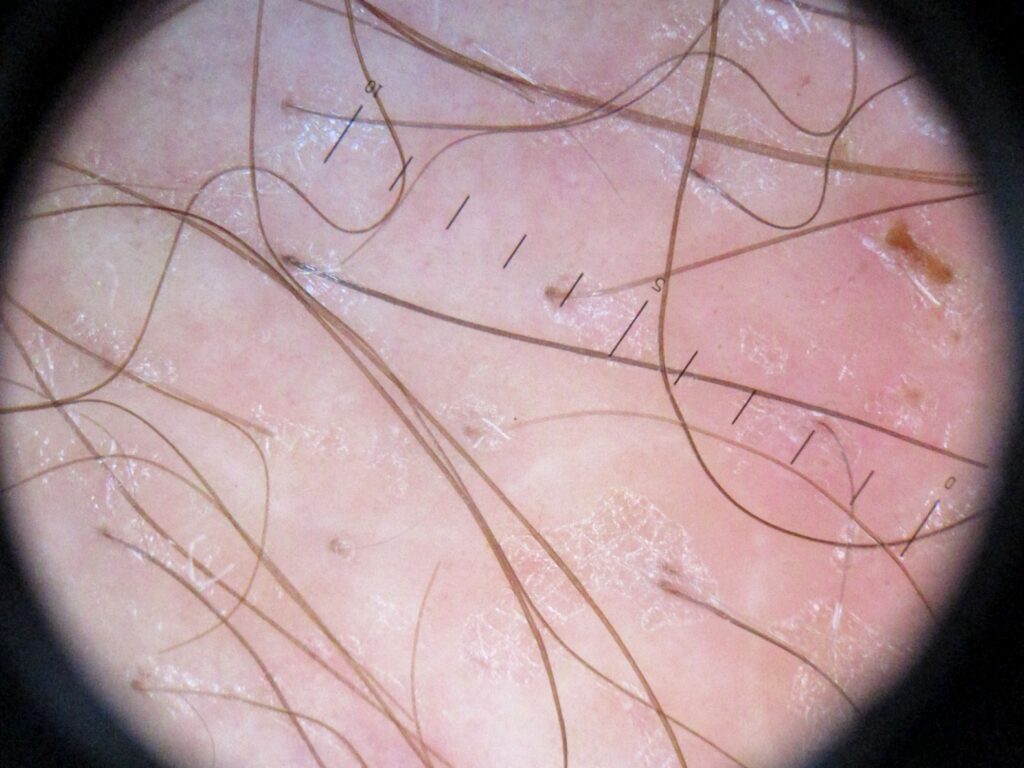
Дерматоскопия — это дополнительный инструмент, используемый для подтверждения диагноза и, возможно, выбора вариантов местного лечения. С помощью поляризационной дерматоскопии можно увидеть овальную структуру с жёлтой периферией и коричневым центром, представляющую тело личинок.
Лечение
Несмотря на то, что КМЛ проходит самостоятельно, сильный зуд и риск инфекции требуют лечения. Обычными вариантами лечения являются пероральный альбендазол, пероральный ивермектин или местный ивермектин.
Прогноз
КМЛ имеет хороший прогноз. Т.к. люди для КМЛ конечный хозяин, то она погибает самостоятельно и высыпания проходят в течение 4-8 недель, хотя иногда могут сохраняться до 1 года. Впрочем, это не значит, что стоит запасаться терпением, так в арсенале врачей есть необходимые противопаразитарные средства.
Список литературы
- Patel S, Sethi A. Imported tropical diseases. Dermatol Ther. 2009 Nov-Dec. 22(6):538-49.
- Tamminga N, Bierman WF, de Vries PJ. Cutaneous larva migrans acquired in Brittany, France. Emerg Infect Dis. 2009 Nov. 15(11):1856-8.
- González F CG, Galilea O NM, Pizarro C K. [Autochthonous cutaneous larva migrans in Chile. A case report]. Rev Chil Pediatr. 2015 Oct 8.
- Veraldi S, Persico MC, Francia C, Schianchi R. Chronic hookworm-related cutaneous larva migrans. Int J Infect Dis. 2013 Apr. 17 (4):e277-9.
- Bowman DD, Montgomery SP, Zajac AM, Eberhard ML, Kazacos KR. Hookworms of dogs and cats as agents of cutaneous larva migrans. Trends Parasitol. 2010 Apr. 26(4):162-7.
- Reichert F, Pilger D, Schuster A, Lesshafft H, Guedes de Oliveira S, Ignatius R, et al. Prevalence and Risk Factors of Hookworm-Related Cutaneous Larva Migrans (HrCLM) in a Resource-Poor Community in Manaus, Brazil. PLoS Negl Trop Dis. 2016 Mar. 10 (3):e0004514.
- Sunderkötter C, von Stebut E, Schöfer H, Mempel M, Reinel D, Wolf G, et al. S1 guideline diagnosis and therapy of cutaneous larva migrans (creeping disease). J Dtsch Dermatol Ges. 2014 Jan. 12 (1):86-91.
- Archer M. Late presentation of cutaneous larva migrans: a case report. Cases J. 2009 Aug 12. 2:7553.
- Podder I, Chandra S, Gharami RC. Loeffler’s Syndrome Following Cutaneous Larva Migrans: An Uncommon Sequel. Indian J Dermatol. 2016 Mar-Apr. 61 (2):190-2.
- Aljasser MI, Lui H, Zeng H, Zhou Y. Dermoscopy and near-infrared fluorescence imaging of cutaneous larva migrans. Photodermatol Photoimmunol Photomed. 2013 Dec. 29 (6):337-8.
- Veraldi S, Angileri L, Parducci BA, Nazzaro G. Treatment of hookworm-related cutaneous larva migrans with topical ivermectin. J Dermatolog Treat. 2017 May. 28 (3):263.
- Hombu A, Yoshida A, Kikuchi T, Nagayasu E, Kuroki M, Maruyama H. Treatment of larva migrans syndrome with long-term administration of albendazole. J Microbiol Immunol Infect. 2017 Jul 14.
- Leung AK, Barankin B, Hon KL. Cutaneous larva migrans. Recent Pat Inflamm Allergy Drug Discov. 2017 Jan 10.