Введение
Импетиго — острая высококонтагиозная грамположительная бактериальная инфекция поверхностных слоев эпидермиса. Существует как классическое первичное импетиго, так и вторичное за счёт импетигинизации предшествующих поражений кожи, таких как порезы, ссадины и ветряная оспа.
Импетиго чаще всего возникает у детей, особенно проживающих в жарком и влажном климате. Считается, что название произошло от латинского impetere (нападать).
Импетиго встречается в двух формах: буллёзной и небуллёзной (является более распространённой формой и составляет примерно 70% случаев). Небуллёзное импетиго вызывается Staphylococcus aureus, бета-гемолитическим стрептококком группы А (Streptococcus pyogenes, далее — GABHS) или их комбинацией. Большинство инфекций начинаются со стрептококковой инфекции, но со временем стрептококки заменяются стафилококками.
Устойчивый к метициллину S.aureus (MRSA) становится всё более распространенной причиной импетиго; этот возбудитель чаще наблюдается при небуллёзной форме импетиго, чем при буллёзной. За последнее десятилетие сообщалось о росте роли внебольничных штаммов MRSA и штаммов S.aureus, устойчивых к гентамицину, в заболеваемости импетиго.
Буллёзное импетиго может поражать неповреждённую кожу и вызывается почти исключительно S.aureus. Буллёзное импетиго — это токсинопосредованная эритродермия, при которой эпидермальный слой кожи отслаивается, что приводит к поражению больших участков кожи.
Эктима — более глубокая изъязвленная инфекция, часто сочетающаяся с лимфаденитом, которая может быть осложнением импетиго. Импетиго редко переходит в системную инфекцию. Редким осложнением GABHS является постстрептококковый гломерулонефрит. Импетиго может также проявляться как фолликулит. Хронический упорный импетиго/фолликулит может привести к сикозу бороды (похожему на волчаночный сикоз) с рубцеванием и проявлениями, сходными с таковыми при дискоидной волчанке.
Диагностика импетиго обычно основывается на анамнезе и клинической картине. Лечение обычно включает местный уход за раной, а также терапию антибиотиками, как местную, так и системную.
Этиология
Импетиго вызвано бактериальной инфекцией. И S.aureus, и GABHS вызывают небуллёзное импетиго; на S.aureus приходится примерно 80% случаев, на GABHS – 10% случаев, и оба микроорганизма выявляются в 10% случаев. Буллёзное импетиго вызывается почти исключительно S.aureus.
Небуллёзное импетиго
Небуллезное импетиго может быть вызвано GABHS (типы 49, 52, 53, 55-57, 59, 61) или S.aureus; примерно в 20–45% случаев присутствуют оба агента. S.aureus продуцирует бактериотоксины, токсичные для стрептококков, что приводит к постепенному вытеснению GABHS из очагов поражения.
В настоящее время на долю S.aureus приходится 50-60% случаев, а в развивающихся странах и странах с тёплым климатом GABHS, по-прежнему, остается более распространённым этиологическим агентом.
Буллёзное импетиго
Преобладающим возбудителем является коагулазоположительная II группа S.aureus. Этот штамм бактерий вырабатывает отшелушивающий токсин, который вызывает расщепление субкорнеального эпидермиса и состояние, известное как стафилококковый синдром ошпаренной кожи (SSSS).
MRSA выявляют в 20% случаев буллёзного импетиго. Среди факторов риска внутрибольничного MRSA можно выделить следующие: работа в медицинском центре, госпитализация в течение последнего года, нахождение в пункте длительного проживания, наличие постоянного постоянного катетера или медицинского устройства.
Внебольничный MRSA чаще встречается в закрытых группах населения в тюрьмах, детских садах и спортивных командах, а также у пациентов с диабетом или сопутствующим заболеванием кожи.
Патофизиология
Интактная кожа обычно устойчива к колонизации или заражению S.aureus или S.pyogenes. Эти бактерии могут попадать на кожу из окружающей среды и лишь временно колонизировать поверхность кожи. Экспериментальные исследования показали, что инокуляция нескольких штаммов S.pyogenes не вызывала кожных заболеваний, если только не происходило повреждение кожи.
Для колонизации GABHS и S.aureus необходима адгезия тейхоевыми кислотами к фибронектину. В случае неповреждённой кожи фибронектин недоступен для связывания, но повреждение кожи обнажает фибронектин и делать возможным колонизацию или инвазию в места повреждений. Факторы, которые могут изменить обычную флору кожи и способствовать временной колонизации GABHS и S.aureus, включают высокую температуру или влажность, ранее существовавшие кожные заболевания, молодой возраст или недавнее лечение антибиотиками.
Общие механизмы повреждения кожи, которые могут способствовать бактериальной колонизации или инфекции, включают следующее: ссадины, травма, атопический дерматит, дерматофития, ветряная оспа, простой герпес, чесотка, педикулёз, термические ожоги, операция, лучевая терапия, укусы насекомых.
Росту и размножению бактерий способствует иммуносупрессия из-за приёма лекарств (например, системных кортикостероидов, пероральных ретиноидов, химиотерапии), системных заболеваний (например, ВИЧ-инфекции, сахарного диабета), внутривенного введения наркотиков и диализа.
После первоначального заражения новые поражения могут появиться на участках без видимых повреждений кожи. Однако при внимательном рассмотрении физические повреждения всё же можно обнаружить.
Колонизация S.pyogenes
Колонизация кожи может происходить при контакте с другими людьми (например, членами семьи, одноклассниками, товарищами по команде), у которых есть кожная инфекция S.pyogenes или которые являются носителями этого микроба. После колонизации здоровой кожи небольшие травмы, такие как ссадины или укусы насекомых, могут привести к развитию импетиго в течение 1-2 недель.
Через 2-3 недели после появления высыпаний импетиго S.pyogenes можно обнаружить в носу и горле у некоторых людей, при этом симптомов стрептококкового фарингита не наблюдается. Это связано с тем, что импетиго и фарингит вызываются разными штаммами бактерий. Импетиго обычно вызывается штаммами типа D, тогда как фарингит вызывается штаммами типа A, B и C.
Колонизация S.aureus
Примерно у 30% населения передняя часть носа колонизирована S.aureus. У некоторых из них наблюдаются повторяющиеся эпизоды импетиго на носу и губе. Бактерии могут распространиться из носа на здоровую кожу в течение 7–14 дней и через 7-14 дней появляется импетиго.
Примерно у 10% людей S.aureus колонизирует промежность и, реже, подмышки, глотку и руки. У большинства здоровых людей S.aureus является временным представителем микробной флоры. У пациентов с атопическим дерматитом или другими воспалительными заболеваниями кожа чаще колонизируется S.aureus; исследования показали, что уровень колонизации S.aureus у пациентов с атопическим дерматитом составляет 60–90%. Пациенты с атопическим дерматитом, особенно с герпетической экземой в анамнезе, подвергаются более высокому риску развития инфекции MRSA.
Одно исследование у пациентов с атопическим дерматитом выявило значительно более низкую экспрессию белков, связанных с кожным барьером и выработкой натурального увлажняющего фактора в поражённых участках по сравнению с неповреждёнными участками. Кроме того, эпидермальный белок, связывающий жирные кислоты, экспрессировался на значительно более высоких уровнях у пациентов, колонизированных MRSA, что может образовывать стойкую воспалительную реакцию посредством передачи воспалительных сигналов через эйкозаноиды.
Буллёзное импетиго
Буллезное импетиго обычно возникает из-за эксфолиативных токсинов S.aureus (эксфолиатины А и В). Эти экзотоксины вызывают потерю клеточной адгезии в поверхностных слоях кожи, что, в свою очередь, вызывает появление пузырей и шелушение кожи из-за расщепления зернистого слоя эпидермиса. Одним из белков-мишеней экзотоксина А является десмоглеин I, который поддерживает клеточную адгезию. Эти молекулы также являются суперантигенами, которые действуют локально и активируют Т-лимфоциты. Коагулаза может образовывать фибриновые тромбы, что ведёт к тому, что эти токсины остаются в верхних слоях эпидермиса. В отличие от небуллёзного импетиго, поражения буллёзного импетиго возникают на неповреждённой коже.
MRSA (чаще это касается внебольничных штаммов) содержит лейкоцидин Пантона-Валентина (P-VL), высоковирулентный порообразующий экзотоксин, вызывающий некроз дермы и обладающий цитолитической активностью в отношении нейтрофилов и моноцитов. Разрушение лейкоцитов лейкоцидином является одной из причин того, что MRSA с большей вероятностью вызовет клинически заметную инфекцию. P-VL-положительные штаммы S.aureus чаще ассоциированы с целлюлитом (38%) и абсцессами (75%). У пациентов с иммунодефицитом или ослабленным иммунитетом токсин может распространяться гематогенно и приводить к SSSS.
Эпидемиология
Статистика США. Импетиго составляет примерно 10% проблем с кожей, наблюдаемых в педиатрических клиниках. Это наиболее распространенная бактериальная инфекция кожи и третье по распространённости кожное заболевание среди детей. Импетиго чаще встречается в тёплых и влажных регионах, чем в более прохладных северных широтах. Распространённость импетиго варьируется в зависимости от сезона, с пиком заболеваемости летом и осенью; однако в регионах, где тепло и влажно в течение всего года, сезонность может отсутствовать.
Международная статистика. Импетиго чаще встречается в тропическом климате и на низких высотах. Тёплые и влажные условия тропического климата в сочетании с частыми укусами насекомых способствуют его развитию в течение всего года. Перенаселённость или плохая гигиена также способствуют развитию импетиго. Британская статистика, опубликованная в 1995, показывает, что ежегодная заболеваемость импетиго составляет 2,8% у детей в возрасте 4 лет и младше и 1,69% у детей в возрасте 5-15 лет. Сообщается, что импетиго является третьим по частоте заболеванием кожи у детей, наблюдаемым врачами общей практики в Нидерландах, со средней заболеваемостью 10,8–22,2 случая на 1000 детей в год, в зависимости от географического региона страны. В обсервационном исследовании, проведённом в Квинсленде (Австралия), импетиго было диагностировано у 22 из 60 пациентов (37%) с гнойными инфекциями кожи; средний возраст составлял 19 лет (диапазон от 2 месяцев до 91 года), 38% пациентов были мужчинами. Систематический обзор распространённости чесотки во всем мире показал, что самым частым бактериальным осложнением является импетиго.
Импетиго может поражать людей всех рас. В целом заболеваемость у мужчин и женщин одинакова; однако у взрослых импетиго чаще встречается у мужчин. Импетиго встречается у людей всех возрастов, но чаще всего встречается у детей 2–5 лет. Быстрое распространение может происходить через детские сады и начальные школы.
Буллёзное импетиго чаще всего встречается у новорожденных и младенцев; 90% случаев встречается у детей младше 2 лет. Если во время родов произошел преждевременный разрыв околоплодных вод, очаги импетиго могут присутствовать при рождении. Некоторые авторы предполагают, что статистика по буллёзному импетиго может быть искажена, поскольку случаи у взрослых часто занижаются.
Клиническая картина
Небуллёзное импетиго начинается с единичного эритематозного пятна, которое быстро превращается в везикулу или в пустулу и разрывается; выделившееся серозное содержимое затем высыхает, оставляя над эрозией корку медового цвета. При снятии корочки обнаруживается влажное эритематозное основание. Поражения кожи могут сливаться в большие очаги. Поражённый участок кожи может увеличиваться по мере распространения инфекции по периферии. Зуд инфицированных участков может привести к появлению раздражений из-за расчёсов.
Быстрое распространение происходит из-за периферического роста очага или из-за расчёсов кожи.
По мере разрешения поражений, спонтанно или после лечения антибиотиками, корки с поражённых участков отслаиваются и заживают без образования рубцов.
Поражения обычно располагаются на лице (вокруг рта и носа) и открытых частях тела (например, руках, ногах) или на участках с нарушением естественного защитного барьера кожи. Ладони и подошвы обычно не поражаются. Окружающая эритема или отёк незначительны или отсутствуют. Регионарная лимфаденопатия имеется у 90% больных.
Буллёзное импетиго обычно состоит из тонких, вялых и прозрачных пузырей, размером до 3 см. Буллы первоначально содержат прозрачную желтую жидкость, которая впоследствии становится мутной и тёмно-желтой. Они быстро появляются, спонтанно разрываются и при осмотре могут наблюдаться лишь остатки покрышки или ободок по периферии. После высыхания очаг поражение имеет вид красно-коричневой или ошпаренной кожи. Буллёзные поражения возникают на неповреждённой коже интертригинозных участков, таких как шея, подмышечные складки и складки голеней, а также в области подгузников, но также могут появляться на лице или в любом месте тела. Окружающей эритемы или отёка нет.
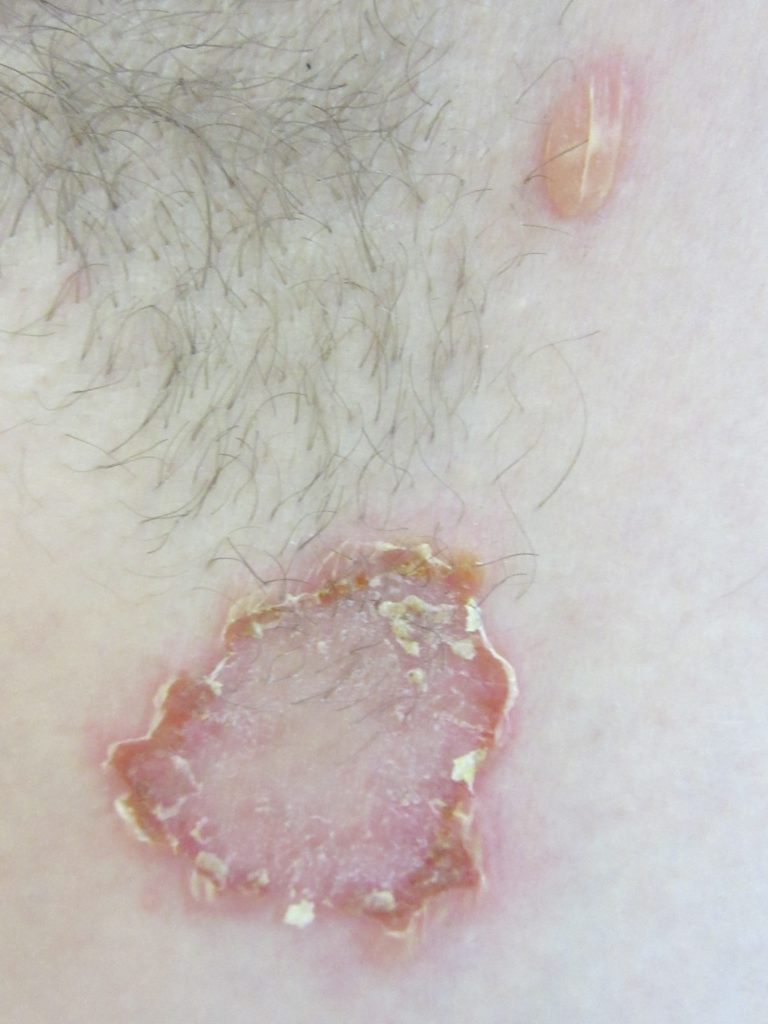
Буллёзное импетиго чаще всего встречается у новорождённых. У младенцев обширные поражения могут сопровождаться системными симптомами, такими как лихорадка, недомогание, общая слабость и диарея.
Буллёзное импетиго отличается от небуллезного импетиго способностью поражать слизистые оболочки щёк. Кроме того, буллёзное импетиго считается менее заразным, чем небуллезное импетиго.
Пациенты с импетиго могут сообщать о небольших травмах, укусах насекомых, чесотке, простом герпесе, ветряной оспе или экземе в месте инфекции. Любое ранее существовавшее кожное заболевание в анамнезе должно вызывать у врача подозрения.
Пациенты с импетиго часто вспоминают контакт с человеком, который является носителем S.aureus или стрептококков, страдает пиодермией или имеет кожное заболевание (например, атопический дерматит), которое предрасполагает к носительству S.aureus.
Жаркая и влажная погода, занятия контактными видами спорта, скученные жилищные условия, плохая личная гигиена или антисанитарные условия труда способствуют загрязнению кожи патогенными бактериями, которые могут вызвать импетиго.
Такие состояния, как ВИЧ-инфекция, трансплантация органов, сахарный диабет, гемодиализ, химиотерапия, лучевая терапия или системное лечение кортикостероидами, повышают восприимчивость к данному заболеванию.
Первичный селективный дефицит IgM связан с рецидивирующим импетиго у пациентов с отрицательным статусом носительства S.aureus и отсутствием предрасполагающих факторов, таких как ранее существовавший дерматоз. Также сообщалось о частых ассоциациях импетиго с дефицитами IgA, IgM и IgG.
Диагностика
Диагностика импетиго обычно основывается исключительно на анамнезе и клинических проявлениях. Бактериальный посев и определение чувствительности рекомендуются: 1) для выявления возможного MRSA; 2) если произошла вспышка импетиго.
У пациентов с небуллёзными поражениями после снятия корок можно получить бактериальную культуру из свежего экссудата. Результаты посева и чувствительности могут помочь врачу выбрать подходящую антибиотикотерапию.
У пациентов с буллёзными поражениями проводят окраску по Граму и посев жидкости из пузырей. При окраске по Граму наличие цепочек грамположительных кокков указывает на S.pyogenes, кокки в группах — S.aureus. Для исключения буллезной дерматофитной инфекции можно провести микроскопическое исследование с гидроксидом калия.
Для исключения инфекции простого герпеса можно выполнить микроскопию с целью выявления клеток Тцанка.
Носительство S.aureus выявляют путём взятия посева из ноздрей, подмышек, глотки и промежности.
Определение уровня IgA, IgM и IgG, включая подклассы IgG, может быть полезным для исключения иммунодефицитных состояний.
Биопсия может быть целесообразна в сомнительных или рефрактерных случаях импетиго. При буллёзном импетиго в пузыре наблюдается небольшое количество или полное отсутствие воспалительных клеток; в верхних слое дермы — полиморфный инфильтрат, в зернистом слое — акантолиз. При небуллёзном импетиго над эпидермисом имеется серозная корка, в которой часто встречаются нейтрофилы и грамположительные кокки, выявляется эпидермальный спонгиоз и выраженный инфильтрат из нейтрофилов и лимфоидных клеток.
Дифференциальный диагноз
Микозы кожи, герпетические высыпания, обыкновенная и листовидная пузырчатки, псевдомонадный фолликулит, фолликулярный муциноз, синдром Свита, линейный IgA-зависимый буллезный дерматоз, фиксированная эритема.
Лечение
Лечение импетиго обычно заключается в местном уходе за поражением и лечении антибиотиками. Антибиотикотерапия импетиго может проводиться только с использованием местного средства или комбинации системных и местных средств.
Рекомендуется мягкое очищение, удаление корок медового цвета небуллёзного импетиго с использованием антибактериального мыла и мочалки, а также частое наложение влажных повязок на поражённые участки.
Местная антибиотикотерапия считается методом выбора для пациентов с неосложнённым локализованным импетиго. Недостатки местного лечения заключаются в том, что оно не может уничтожить микроорганизмы в дыхательных путях и что применение местных препаратов при обширных поражениях затруднено.
Инфекции, которые имеют распространённое, осложнённое или связанное с системными проявлениями течение, обычно лечат антибиотиками, действующими на грамположительных возбудителей.
Прогноз
Даже без лечения импетиго обычно проходит в течение 2–3 недель. В рандомизированных группах плацебо в проспективных клинических исследованиях частота спонтанного разрешения составила 13-52%. Однако лечение обеспечивает более высокий уровень излечения и снижает распространение инфекции на другие части тела или другим людям. Рубцевание встречается редко, но может возникнуть поствоспалительная гиперпигментация или гипопигментация. Невылеченные поражения небуллёзного импетиго редко могут перерасти в эктиму, глубокую кожную инфекцию, после которой может возникнуть последующее рубцевание.
При соответствующем лечении высыпания обычно проходят через 7-10 дней. Если поражения сохраняются и после этого момента, следует провести посев для поиска резистентных организмов. Однако у пациентов с экземой или сопутствующей паразитарной инфекцией течение импетиго может быть затяжным.
Целлюлит, лимфангит и гнойный лимфаденит могут возникать у 10% пациентов с импетиго. Никакой корреляции между количеством импетигинозных поражений и поражением окружающих мягких тканей, лимфатических сосудов или регионарных лимфатических узлов не наблюдалось.
Если эксфолиативные токсины всасываются в кровоток, может возникнуть SSSS. Это чаще происходит у детей младшего возраста, у которых не выработаны антитела против этого токсина.
Острый постстрептококковый гломерулонефрит — редкое осложнение небуллёзного импетиго из нефритогенных штаммов GABHS, с ежегодной заболеваемостью менее 1 случая на 1 000 000 населения в развитых странах. Постстрептококковый гломерулонефрит развивается обычно через 10 дней после первого появления импетиго, но может возникнуть и через 1-5 недель. Преходящая протеинурия и гематурия могут возникнуть во время импетиго и исчезнуть до развития поражения почек. Лечение антибиотиками не предотвращает развитие гломерулонефрита.
Профилактика
Детям с импетиго следует по возможности избегать тесного контакта с другими детьми. Рекомендуется своевременное приучение детей к личной гигиене. Не рекомендуется прикасаться к поражённым местам.
Пациентам с рецидивирующим импетиго, бессимптомным членам семьи и назальным носителям S.aureus назначают 2% крем или мазь мупироцина для нанесения внутрь ноздрей 3 раза в день в течение 5 дней каждый месяц.
Информируйте пациентов о раннем и правильном лечении предрасполагающих факторов (например, укусов насекомых, незначительных травм).
Список литературы
- Moulin F, Quinet B, Raymond J, Gillet Y, Cohen R. [Managing children skin and soft tissue infections]. Arch Pediatr. 2008 Oct. 15 Suppl 2:S62-7.
- Moran GJ, Amii RN, Abrahamian FM, Talan DA. Methicillin-resistant Staphylococcus aureus in community-acquired skin infections. Emerg Infect Dis. 2005 Jun. 11(6):928-30.
- Cole C, Gazewood J. Diagnosis and treatment of impetigo. Am Fam Physician. 2007 Mar 15. 75(6):859-64.
- Geria AN, Schuartz RA. Impetigo Update: New Challenges in the Era of Methicillin Resistance. Cutis. 2010. 85(2):65-70.
- Daskalaki M, Rojo P, Marin-Ferrer M, Barrios M, Otero JR, Chaves F. Panton-Valentine leukocidin-positive Staphylococcus aureus skin and soft tissue infections among children in an emergency department in Madrid, Spain. Clin Microbiol Infect. 2010 Jan. 16(1):74-7.
- Loffeld A, Davies P, Lewis A, Moss C. Seasonal occurrence of impetigo: a retrospective 8-year review (1996-2003). Clin Exp Dermatol. 2005 Sep. 30(5):512-4.
- Razmjou RG, Willemsen SP, Koning S, et al. Determinants of regional differences in the incidence of impetigo. Environ Res. 2009 Jul. 109(5):590-3.
- Spurling G, Askew D, King D, Mitchell GK. Bacterial skin infections—an observational study. Aust Fam Physician. 2009 Jul. 38(7):547-51.
- Romani L, Steer AC, Whitfeld MJ, Kaldor JM. Prevalence of scabies and impetigo worldwide: a systematic review. Lancet Infect Dis. 2015 Aug. 15 (8):960-7.
- Bangert S, Levy M, Hebert AA. Bacterial resistance and impetigo treatment trends: a review. Pediatr Dermatol. 2012 May-Jun. 29(3):243-8.
- Koning S, van der Sande R, Verhagen AP, van Suijlekom-Smit LW, Morris AD, Butler CC, et al. Interventions for impetigo. Cochrane Database Syst Rev. 2012 Jan 18. 1:CD003261.
- Belgemen T, Suskan E, Dogu F, Ikinciogullari A. Selective immunoglobulin M deficiency presenting with recurrent impetigo: a case report and review of the literature. Int Arch Allergy Immunol. 2009. 149(3):283-8.
- [Guideline] Rush, J and Dinulos JG. Childhood skin and soft tissue infections: new discoveries and guidelines regarding the management of bacterial soft tissue infections, molluscum contagiousum, and warts. Current Opinion in Pediatrics. April 2016. 28(2):250-257.
- American Academy of Pediatrics. Staphylococcal infections. Pickering LK, ed. Red Book: 2012 Report of the Committee on Infectious Diseases. 30th ed. Elk Grove Village, IL: American Academy of Pediatrics; 2015. 715-732.