Введение
Опоясывающий лишай (опоясывающий герпес) представляет собой острую кожную вирусную инфекцию, вызванную реактивацией вируса ветряной оспы (VZV). Первый контакт с вирусом влечёт за собой появление классических проявлений ветряной оспы, реактивания — появление опоясывающего лишая.
Опоясывающий лишай чаще всего возникает в результате неспособности иммунной системы сдерживать латентную репликацию VZV. Точно не установлено, могут ли другие факторы, такие как радиация, физическая травма, определённые лекарства, другие инфекции и стресс, также вызывать лишай. Также не совсем ясно, почему циркулирующие антитела к вирусу и клеточно-опосредованные иммунные механизмы не предотвращают рецидивы. Предполагается, что у пациентов с нормально функционирующей иммунной системой, опоясывающий лишай возникает, когда титры антител к VZV и клеточный иммунитет падают до уровней, которые больше не являются полностью эффективными для предотвращения вирусной реактивации. Доказательства этой гипотезы включают в себя наблюдение, что у педиатров, которые предположительно повторно подвергаются воздействию VZV и, таким образом, поддерживают высокий уровень иммунитета, редко развивается опоясывающий лишай.
Опоясывающий герпес может иметь разные клинические проявления, порой требующие немедленного осмотра и лечения. Основным осложнением опоясывающего лишая является постгерпетическая невралгия (ПГН).
Этиология
VZV представляет собой оболочечный двухцепочечный ДНК-вирус, принадлежащий к семейству Herpesviridae, геном которого кодирует примерно 70 белков. У человека первичное заражение VZV происходит при контакте вируса со слизистой оболочкой дыхательных путей или конъюнктивы, далее вирус распространяется по всему телу. После первичной инфекции вирус мигрирует по сенсорным нервным волокнам к сателлитным клеткам спинномозговых ганглиев, где он переходит в состояние покоя.
Реактивация VZV, который оставался бездействующим в ганглиях задних корешков, часто спустя десятилетия после первоначального контакта пациента с вирусом в форме ветряной оспы (ветряной оспы), приводит к опоясывающему герпесу. Что именно вызывает эту реактивацию, ещё точно не определено, но вероятные кандидаты (по отдельности или в сочетании) включают следующее:
— внешний повторный контакт с вирусом
— острые или хронические патологические процессы (особенно злокачественные новообразования и инфекции)
— лекарства разных видов
— эмоциональный стресс
Причина, по которой реактивация вируса происходит в одном ганглие дорсальных корешков, а в других нет, неясна. Т.к заболеваемость увеличивается с возрастом и у лиц с ослабленным иммунитетом, то предполагается, что риск реактивации связан со снижением клеточного иммунитета,
Опоясывающий лишай может быть симптомом гиперпаратиреоза, он встречается в 2 раза чаще (частота 3,7%) среди пациентов с гиперкальциемией (по сравнению с когортой пациентов старше 40 лет с нормальным уровнем кальция).
Причина ПГН также остается загадкой. Быстрое начало лечения существенно снижает частоту ПГН. Существует теория, что появление ПГН связано с формированием петли положительной обратной связи в таламусе и коре головного мозга, создающей центральный болевой синдром, похожий на фантомную боль в ногах. Согласно этой теории, своевременное лечение уменьшает боль на ранних стадия заболевания и тем самым разрывает эту петлю.
Известные факторы риска развития опоясывающего лишая связаны с состоянием клеточно-опосредованного иммунитета к VZV. Факторы риска у детей и взрослых включают следующее:
— VZV-специфический иммунитет и клеточно-опосредованный иммунитет, который обычно снижается с возрастом
— иммуносупрессия (например, при ВИЧ-инфекции или СПИДе)
— иммуносупрессивная терапия
— первичная инфекция VZV внутриутробно или в раннем детстве, когда нормальный иммунный ответ снижен
— лекарства против фактора некроза опухоли-альфа
— воспалительный синдром восстановления иммунитета (ВСВИ)
— острый лимфолейкоз и другие злокачественные новообразования
ВСВИ представляет собой парадоксальное ухудшение клинического состояния, которое развивается у пациента, получающего антиретровирусное лечение, несмотря на удовлетворительный контроль репликации вируса и улучшение количества CD4. У таких пациентов могут быть признаки и симптомы ранее субклинической и нераспознанной инфекции опоясывающего герпеса в виде парадоксального ухудшения ответа на лечение через несколько недель после начала антиретровирусной терапии (АРТ). Появление опоясывающего герпеса в течение 8–12 недель после начала АРТ должно стать поводом для рассмотрения вопроса о ВСВИ. В таких случаях особенно важны раннее распознавание и своевременное лечение наряду с продолжением высокоактивной АРТ.
Исследования показывают, что у пациентов с воспалительным заболеванием кишечника (ВЗК) значительно повышен риск опоясывающего герпеса. При анализе более 108 000 пациентов с ВЗК и 430 000 человек из контрольной группы общая годовая заболеваемость на 100 000 человеко-лет составила 734 среди пациентов с ВЗК по сравнению с 437 у пациентов без ВЗК. Повышенный риск у пациентов с ВЗК сохранялся после поправки на сопутствующие заболевания и другие факторы. Лечение тиопуринами, кортикостероидами и биологическими агентами против фактора некроза опухоли-альфа было независимо связано с повышенным риском опоясывающего герпеса.
В популяционном исследовании методом случай-контроль, проведенном в Соединенном Королевстве и направленном на количественную оценку воздействия факторов риска в разном возрасте, 144 959 взрослых, у которых в период с 2000 по 2011 год был диагностирован опоясывающий герпес, сравнивали с 549 336 контрольными субъектами того же возраста (средний возраст 62 года) и пола. Следующие факторы были связаны с повышенным риском заболевания:
— ревматоидный артрит (2,1% против 1,5%)
— ВЗК (1,3% против 0,9%)
— хроническая обструктивная болезнь легких (4,7% против 3,7%)
— астма (7,1% против 5,8%)
— хроническая болезнь почек (6,0% против 5,4%)
— депрессия (4,7% против 4,0%)
Для многих оцениваемых факторов риска относительные эффекты были выше у молодых людей. Наибольший риск опоясывающего лишая наблюдался у пациентов с тяжелыми иммуносупрессивными состояниями (например, лимфомой и миеломой).
Патофизиология
Инфекция VZV вызывает два различных синдрома. Первичная инфекция, ветряная оспа, является заразным и обычно доброкачественно протекающим лихорадочным заболеванием. После стихания активного инфекционного процесса вирусные частицы остаются в задних корешках спинного мозга или других сенсорных ганглиях, где они могут сохраняться в неактивном состоянии в течение многих лет или десятилетий. В ганглии вирус, как предполагается, может попадать 2 путями: центростремительно по сенсорным нервам из первичных высыпаний ветряной оспы и путем гематогенного распространения во время виремической фазы ветряной оспы.
В латентный период иммунологические механизмы хозяина подавляют репликацию вируса, но VZV реактивируется, когда механизмы хозяина не могут сдерживать вирус. Это может быть результатом широкого спектра состояний, от стресса до тяжёлой иммуносупрессии. Виремия VZV часто возникает при ветряной оспе, но также может возникать при опоясывающем герпесе, хотя и с более низкой вирусной нагрузкой.
Как только VZV активируется в нейронах спинного мозга или черепномозговых нервов (ЧМН), возникает воспалительная реакция, которая также распространяется на лептоменинкс. Это воспаление в спинномозговом ганглии может сопровождаться геморрагическим некрозом нервных клеток, что приводит к потере нейронов и фиброзу.
Появление кожной сыпи из-за опоясывающего герпеса совпадает с выраженной пролиферацией Т-клеток, специфичных к VZV. У иммунокомпетентных пациентов специфические антитела (IgG, IgM и IgA) появляются быстрее и достигают более высоких титров при реактивации (опоясывающий герпес), чем при первичной инфекции. В дальнейшем у пациента наблюдается длительный усиленный клеточно-опосредованный иммунный ответ на VZV. Эта инфекция заразна для лиц, ранее не имевших иммунитета к VZV.
Эпидемиология
В Соединенных Штатах примерно 95% взрослых и 99,5% взрослых в возрасте 40 лет и старше имеют антитела к VZV и, таким образом, подвержены реактивации инфекции. У человека любого возраста с предшествующей инфекцией ветряной оспы может развиться опоясывающий лишай, но заболеваемость увеличивается с возрастом из-за снижения иммунитета. В общей популяции уровень заболеваемости в течение жизни составляет 10-20%, который возрастает до 50% у лиц, доживших до 85 лет. Частота ПГН также увеличивается с возрастом.
Рецидивирующий опоясывающий лишай встречается почти исключительно у людей с ослабленным иммунитетом. Приблизительно 25% пациентов с ВИЧ и 7-9% лиц, перенесших трансплантацию почки или сердца, имеют эпизод опоясывающего лишая в анамнезе.
Офтальмологический опоясывающий герпес составляет 10-15% всех случаев опоясывающего герпеса. Примерно у половины таких больных развиваются осложнения, риск которых не коррелирует с возрастом, полом или тяжестью сыпи.
Опоясывающий герпес редко встречается у детей и молодых взрослых, за исключением более молодых пациентов со СПИДом, лимфомой, другими злокачественными новообразованиями и другими иммунодефицитами, а также у пациентов, перенесших трансплантацию костного мозга или почки. Менее 10% больных зостером моложе 20 лет, и только 5% моложе 15 лет.
Несмотря на то, что опоясывающий герпес в первую очередь является болезнью взрослых, он отмечается уже в первую неделю жизни у младенцев, рождённых от матерей, перенесших ветрянку во время беременности.
Заметных отличий заболеваемости по полу нет. В одном исследовании сообщалось о более высокой распространенности среди женщин, чем среди мужчин.
Клиническая картина
Опоясывающий герпес может начинаться с системной реакции (например, лихорадки, анорексии и утомления), хотя симптомы часто бывают лёгкими, ни пациент, ни врач могут не связать их с классическими высыпаниями.
Симптомы обычно включают продромальные сенсорные явления вдоль 1 или более кожных дерматомов, длящиеся 1-10 дней (в среднем 48 часов), которые обычно ощущаются как боль или, реже, зуд или парестезии. Продромальная боль обычно описывается как мышечная или зубная боль, также может симулировать головную боль, ирит, плеврит, плечевой неврит, кардиалгию, аппендицит или другое заболевание органов брюшной полости или ишиас. Это может привести к неправильным предварительным диагнозам, но появление кожных высыпаний обычно помогает уточнить диагноз. Считалось, что продромальный болевой период до появления кожной сыпи отражает распространение частиц вируса вдоль чувствительных нервов, но примерно 10% пациентов сообщают об одновременном появлении боли и сыпи.
После появления продромальных симптомов возникают следующие признаки и симптомы:
— очаговая эритема, иногда сопровождающаяся уплотнением, в области пораженного дерматома
— регионарная лимфаденопатия
— сгруппированные герпетиформные везикулы, развивающиеся на эритематозном фоне (классическая находка)
— боль в поражённом дерматоме может оставаться такой же, как и в продромальном периоде, или может изменяться по характеру и интенсивности при появлении других симптомов (пациенты описывают боль как жгучую, пульсирующую или колющую, она может быть тяжёлой, лёгкой, постоянной, редкой или ощущаться как зуд
— эволюция сыпи (везикулярная инволюция) — изначально прозрачные везикулы со временем мутнеют, разрываются, образуются корки и отпадают, что может быть значительно ускорено лечением
— после везикулярной инволюции медленное рассасывание оставшихся эритематозных бляшек, как правило, без видимых последствий; рубцевание может возникать при вовлечении в процесс глубоких эпидермальных и дермальных слоёв из-за экскориаций, вторичной инфекции или других осложнений
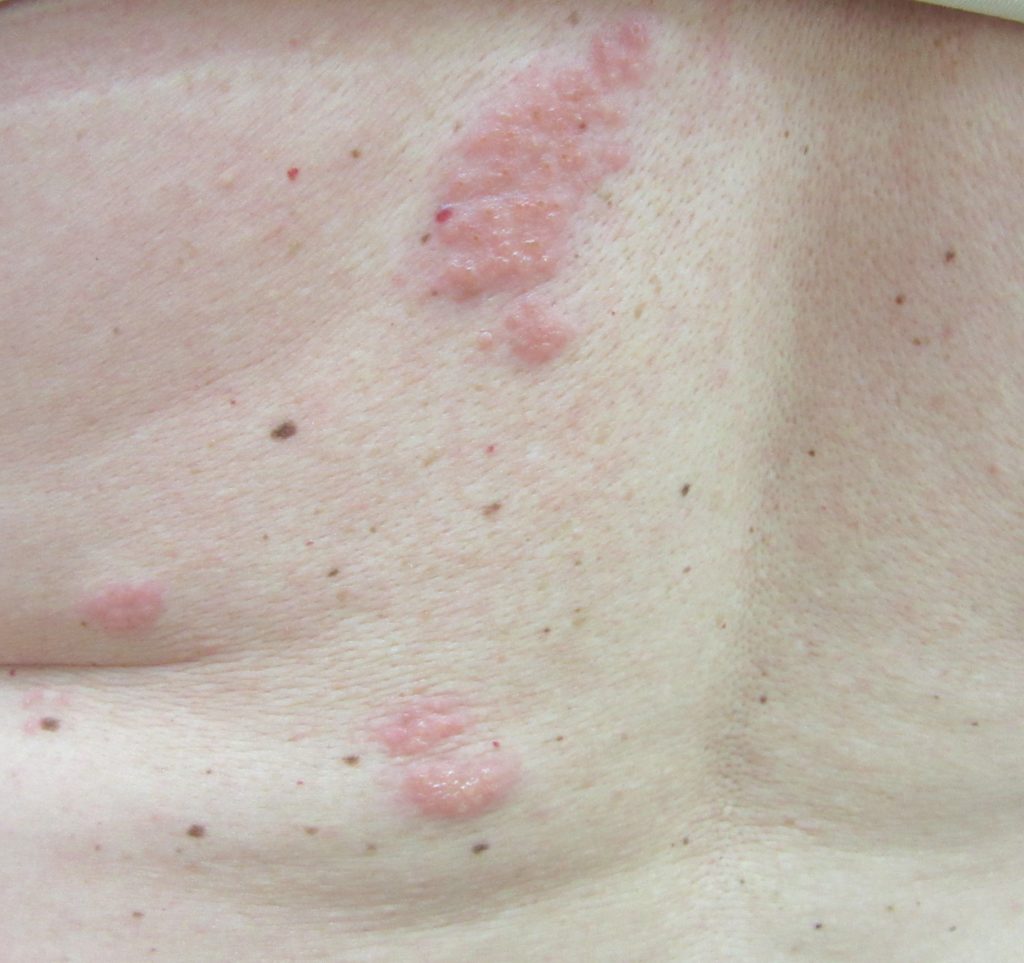
Двигательная слабость, особенно в поясничном и шейном отделах присутствует часто, но остается нераспознанной и свидетельствует о вирусной активности за пределами чувствительных корешков. Из-за отсутствия диагностики слабости её точная частота и распространенность остаются неопределенными.
Исчезновение сопутствующей боли не всегда совпадает с разрешением эритемы и везикуляции. Постгерпетическая невралгия (ПГН), которая обычно ограничивается областью первоначального кожного поражения, может сохраняться в течение недель, месяцев или лет и часто протекает тяжёло. Сильная продромальная боль и плотность герпетических высыпаний были охарактеризованы как факторы риска и предикторы ПГН. Почти у 50% пациентов старше 70 лет ПГН длится более 12 месяцев. Чаще ПГН страдают ослабленные пациенты или с атеросклерозом. Кроме того, ПГН чаще наблюдается после случаев офтальмологического опоясывающего герпеса (ООГ) и в случаях поражения кожи верхней части тела.
Другие менее распространенные постгерпетические последствия включают гиперестезию или, реже, гипестезию или анестезию в области поражения.
Ушной опоясывающий герпес (синдром Рамсея-Ханта) может дополниться синдромом яремного отверстия (синдром Верне). Он характеризуется остро начавшейся дисфагией и дисфонией, часто сопровождаемой или предшествующей черепной, шейной или глоточной болью. В данном случае герпетические высыпания на коже или слизистых оболочках могут возникать, могут обнаруживаться поздно после начала заболевания, оставаться незамеченными или вовсе отсутствовать.
Опоясывающий герпес может присутствовать в нескольких дерматомах, возможен также двусторонний процесс. Частота множественного, диссеминированного и висцерального опоясывающего герпеса увеличена в популяции с ослабленным иммунитетом. Иногда пациенты испытывают парестезии и боли в дерматомах без сыпи (т. е. zoster sine herpete). Также возможны отдельные герпеса, что приведено далее.
Офтальмологический опоясывающий герпес (ООГ)
ООГ возникает в результате вирусной инвазии Гассерова узла и составляет 10-15% случаев опоясывающего лишая. В дополнение к классическим симптомам и поражениям опоясывающего герпеса проявления ООГ включают конъюнктивит, склерит, эписклерит, кератит, иридоциклит, зрачок Аргайла-Робертсона, глаукому, ретинит, хориоидит, неврит зрительного нерва, атрофию зрительного нерва, ретробульбарный неврит, экзофтальм, ретракцию век, птоз и параличи экстраокулярных мышц.
ООГ развивается, когда тройничный нерв задействован при реактивации вируса. По неизвестным причинам поражение глазной ветви этого нерва (V1) встречается в 5 раз чаще, чем поражение верхнечелюстной (V2) или нижнечелюстной ветви (V3). ООГ легко распознать по везикулярному и эритематозному поражению дерматома V1. При обнаружении поражений в дерматоме V1 рекомендуется проведение исследования с помощью щелевой лампы для выявления изменений роговицы.
Ипсилатеральное поражение преаурикулярных и, иногда, подчелюстных лимфатических узлов является частым продромальным событием ООГ и часто воспринимается как боль. Продромальную лимфаденопатию не следует путать с поздней реактивной лимфаденопатией, вызванной вторичным инфицированием везикул. Головные боли, тошнота и рвота также являются частыми продромальными симптомами.
При данной форме лишая могут присутствовать признаки раздражения мозговых оболочек, в связи с этим необходимо исключить менингит. Связь V1 с ресничным узлом, наличие возвратных нервов Арнольда (оболочечная (тенториальная) ветвь глазного нерва), связь с III и VI ЧМН может объяснить частоту менингеальных симптомов и случайные параличи.
При ООГ требуется активное лечение и последующее наблюдение из-за риска поражения глаз, которое встречается примерно у 50% пациентов с ООГ. Традиционно поражение назоцилиарных ветвей, характеризующееся наличием везикул на кончике носа, указывало на наличие или неизбежность поражения глаз (правило Хатчинсона). Это правило в настоящее время оспаривается, при этом некоторые эксперты утверждают, что вовлечение глаз и носовых ветвей может присутствовать без таких пузырьков.
При отсутствии своевременного выявления и лечения поражение глаз представляет опасность для зрения. Наличие отёка орбиты является неотложной офтальмологической ситуацией, и пациенты должны быть немедленно направлены на специализированное офтальмологическое обследование и лечение. В этих случаях возможны ирит, иридоциклит, глаукома, изъязвление тканей роговицы. Т.к. V2 иннервирует нижнее веко, считается, что вовлечение только области ниже глазной щели, без вовлечения верхнего века или носа с меньшей вероятностью приведет к глазным осложнениям.
Постгерпетические осложнения при ООГ встречаются чаще, чем при других проявлениях опоясывающего лишая. В частности, ПГН наблюдается более чем у 50% пациентов и может быть тяжёлой и длительной. Рубцевание также более распространено, вероятно, в результате сильного деструктивного воспаления.
Как отмечалось выше, может возникать паралич III, IV и VI ЧМН. В редких случаях сообщалось об одновременном вовлечении других нервов. Наиболее частым таким событием является вовлечение VII нерва, что может вызвать соответствующий паралич.
Внутриротовой опоясывающий герпес
ООГ может поражать кожу или слизистую ротовой полости, или и то, и другое одновременно. Опоясывающий герпес тройничного нерва с синдромом Рамсея-Ханта может вызывать кожные, внутриротовые и ушные высыпания, потерю слуха и лёгкий паралич лицевого нерва. Опоясывающий герпес верхнечелюстной ветви тройничного нерва может начинаться с зубной боли на продромальной стадии, за которой следует появление типичной сыпи. Верхнечелюстной опоясывающий герпес может вызывать симптомы, напоминающие некроз пульпы и апикальный периодонтит.
Области поражения нижней ветви включают боковую часть головы, наружное ухо и наружный слуховой проход, нижнюю губу и часть слизистой оболочки полости рта. Как и при поражении других ветвей тройничного нерва, продромальная боль в поражённых участках может привести к неправильной диагностике.
Ушной опоясывающий герпес
Синдром Рамсея-Ханта 2 типа, невралгия коленчатого сустава или ушной опоясывающий герпес вызывается реактивацией VZV с вовлечением лицевого и слухового нервов. Этот синдром может остаться незамеченным и его трудно диагностировать, особенно у пожилых пациентов. Везикулярные высыпания могут проявляться на ушной раковине, козелке, барабанной перепонке или в слуховом проходе, а также в любом месте иннервации лицевого нерва. Пациент может испытывать нарушение слуха, нистагм, головокружение или паралич лицевого нерва, имитирующий паралич Белла. Пациенты могут потерять вкусовые ощущения в передних двух третях языка.
Опоясывающий герпес гортани и глотки
Опоясывающий лишай языкоглоточного нерва (herpes pharyngis) и блуждающего нерва (herpes laryngis) поражает яремные и каменистые ганглии, которые соседствуют и часто поражаются вместе с преобладанием одного из них. Болезненная везикулярная сыпь обычно поражает нёбо, заднюю часть языка, надгортанник, нёбные дужки и, иногда, наружное ухо. Одностороннее распространение позволяет отличить эту разновидность опоясывающего герпеса от простого герпеса и герпетической ангины.
Опоясывающий герпес затылочной области
В данном случае герпес поражает заднюю часть головы, затылочную область, части уха, а также части нижней челюсти и передней части шеи. Позвоночные нервы С2 и С3 часто вовлекаются вместе. Ветви этих двух позвоночных нервов сообщаются с VII и X ЧМН, и иногда вызывают симптомы, связанные с этими нервами. Вовлечение затылка или волосистой части головы иногда путают с фолликулитом, фурункулезом, целлюлитом, рожистым воспалением или келоидными угрями затылка. Болезненный продромальный период может привести к путанице и ошибочному диагнозу, пока не появится классическая везикулярная сыпь.
Опоясывающий герпесный энцефаломиелит
Опоясывающий герпесный энцефаломиелит может привести к локализованному легкому лептоменингиту. Это встречается чаще, чем принято считать, и часто приводит к плеоцитозу в спинномозговой жидкости. Лептоменингит, скорее всего, возникает при поражении черепных нервов (особенно тройничного) из-за наличия возвратных нервов Арнольда. По этой причине менингеальные симптомы (например, головная боль, сенсорные изменения, лихорадка и ригидность затылочных мышц) наиболее характерны для ООГ. В редких случаях симптомы менингоэнцефалита могут быть значительными и угрожающими жизни. Распространение процесса в центральную нервную систему может происходить при подавлении резистентности хозяина новообразованиями, цитотоксическими препаратами и, возможно, лучевой терапией.
Опоясывающий герпесный миелит
То, что VZV может вызывать энцефаломиелит, хорошо задокументировано. Миелит преобладает реже. Клиническая картина представляет собой острое начало параплегии в результате диффузного поражения спинного мозга. Клиническая картина связана с острой поперечной миелопатией.
Вовлечение спинного мозга становится очевидным в течение 2-3 недель после первоначальной сыпи с миелопатическими проявлениями (обычно двусторонними). Заболевание может прогрессировать в течение 3 недель, хотя у больных СПИДом сообщалось о нескольких случаях прогрессирования в течение 6 месяцев.
Диссеминированный опоясывающий герпес
Диссеминированный опоясывающий герпес обычно определяется как генерализованное высыпание, выходящее за пределы поражённого дерматома и возникающее через 7-14 дней после появления классического опоясывающего герпеса. Это происходит примерно в 2% случаев лишая в общей популяции, но наблюдается у 35% госпитализированных пациентов или пациентов с ослабленным иммунитетом.
Диссеминация часто является признаком угнетения клеточно-опосредованного иммунитета, вызванного различными клиническими ситуациями, в том числе злокачественными новообразованиями, лучевой терапией, химиотерапией рака, трансплантацией органов и длительным применением системных кортикостероидов (кратковременное применение низких и умеренных доз кортикостероидов не увеличивает частоту диссеминации). Пациенты с диссеминированной формой должны тщательно наблюдаться на предмет развития пневмонита и энцефалита, которые могут быть опасными для жизни.
Односторонний опоясывающий герпес с вовлечением нескольких дерматомов
Вовлечение более чем одного дерматома в одностороннем процессе встречается редко и обычно считается связанным с нарушениями иммунной системы, вызванными СПИДом, злокачественными новообразованиями, химиотерапией и другими факторами.
Двусторонний опоясывающий герпес
В редких случаях опоясывающий лишай проявляется двусторонним поражением. Двусторонние проявления всегда должны вызывать подозрения в отношении диссеминированного заболевания (и иммунодефицита) или альтернативного диагноза.
В случаях двустороннего опоясывающего лишая нередко вовлекаются 1 или 2 соседних дерматома. В отличие от примеров множественного поражения дерматомов при одностороннем заболевании, поражение соседних дерматомов обычно не является признаком основного заболевания (например, злокачественного новообразования).
Рецидивирующий опоясывающий герпес
Рецидивы опоясывающего герпеса случаются редко и не ограничиваются людьми с ослабленным иммунитетом. Заболеваемость опоясывающим герпесом составляет 5,1 случая на 1000 человеко-лет; частота рецидивов была рассчитана как 12 случаев на 1000 человеко-лет. Факторы риска включают пожилой возраст (51-70 лет) и связанную с опоясывающим лишаем боль продолжительностью более 30 дней. Во многих предполагаемых случаях рецидивирующего опоясывающего герпеса причиной могут выступать другие возбудители, обычно это простой герпес с линейным распространением.
Опоясывающий герпес с вовлечением мочевого пузыря
В редких случаях опоясывающий лишай, поражающий дерматомы ягодичной области (позвоночные нервы L1, L2, S2, S3, S4), может быть связан с поражением слизистой мочевого пузыря, что может вызывать сильную дизурию и учащение мочеиспускания. Эту картину легко спутать с картиной цистита. При разрыве пузырьков в мочевом пузыре может возникнуть гематурия (ещё один распространенный симптом цистита). Сообщалось о транзиторном параличе мочевого пузыря в результате опоясывающего лишая, поражающего ягодичные и крестцовые области и поясничные симпатические сегменты. Кроме того, возможна острая задержка мочи при наличии поражения двигательных нейронов.
Опоясывающий герпес с вовлечением других внутренних органов
Сообщалось о везикулярном поражении бронхов, плевральных полостей и желудочно-кишечного тракта. Сообщалось также о зостерной пневмонии. Такое вовлечение часто встречается у людей со значительно ослабленной иммунной системой. Боль в этих областях, как и боль на коже не обязательно свидетельствует о наличии везикул.
Опоясывающий герпес с двигательными осложнениями
Хотя VZV обычно поражает только чувствительные нервы (по неизвестным причинам), вирусные частицы иногда проникают в передние рога пораженного ганглия и вызывают соответствующие симптомы. Эти симптомы варьирую от слабости до полного паралича, в зависимости от того, сколько корешков вовлечённого нервного сплетения поражено. В то время как большинство двигательных нарушений (как и большинство сенсорных поражений) купируются самостоятельно, частичный или полный парез может сохраняться неопределенно долго, особенно при поражении V и VII ЧМН, диафрагмальных нервов и нервов конечностей. Парез чаще всего наблюдается при поражении мышц руки или ноги, однако это может быть связано с тем, что его легче всего обнаружить в этих местах. Изменение моторики туловища может быть более частым, чем принято считать, т.к. небольшой участок мышечной слабости может быть малозаметен. Паралич брюшной мускулатуры может вызвать грыжевое выпячивание.
Опоясывающий герпес без высыпаний
Некоторые случаи реактивации VZV приводят к состоянию, известному как zoster sine herpete. Пациенты испытывают боль и слабость в дерматомах, наблюдаются болезненные эритематозные односторонние пятна или бляшки, но видимых везикул нет. Как и при типичном опоясывающем герпесе в продромальный период обычно наблюдается дизестезии. ДНК VZV может быть обнаружена с помощью полимеразной цепной реакции (ПЦР) в мазках из ротоглотки у пациентов с опоясывающим периферическим параличом лицевого нерва. Поскольку такие исследования не являются рутинными, истинная заболеваемость и распространенность неизвестны. Одно исследование показало, что герпес наблюдается у 8-25% пациентов с острым периферическим параличом лицевого нерва без кожных везикул.
Прогноз
Сыпь обычно проходит в течение 10-15 дней. Прогноз для более молодых и в остальном здоровых пациентов отличный. У пожилых людей значительно повышен риск осложнений.
Болезнь редко приводит к летальному исходу у иммунокомпетентных пациентов, но может быть опасной для жизни у сильно ослабленных пациентов или пациентов с ослабленным иммунитетом. Диссеминированный лишай у пациентов с ослабленным иммунитетом может привести к смерти от энцефалита, гепатита или пневмонита. Пациенты с активными лимфопролиферативными злокачественными новообразованиями относятся к группе особого риска. Смертность от диссеминированного опоясывающего герпеса составляет от 5% до 15%.
Анализ 2017 года показывает, что недавно диагностированный опоясывающий герпес повышает риск инфаркта миокарда и инсульта. Результаты показали увеличение риска комбинированных сердечно-сосудистых событий на 41%. Противовирусное лечение и вакцинация могут снижать риски.
Дифференциальная диагностика
Инфекция, вызванная вирусом простого герпеса, может быть рецидивирующей и проявляться в дерматомах, имитируя опоясывающий герпес и приводя к ошибочному диагнозу, если не проводятся подтверждающие лабораторные тесты.
Ограниченная лимфангиома иногда также может напоминать опоясывающий герпес.
В случае тяжелобольных или пациентов с ослабленным иммунитетом при поражении центральной нервной системы в форме менингоэнцефалита или энцефалита не следует забывать про другие инфекционные болезни.
В дополнение к вышеуказанным состояниям также следует помнить о холецистите и желче- и мочекаменной болезни, коксакивирусной инфекции, конъюнктивите, невралгии тройничного нерва, атипичной кори, пиодермии, стенокардии, герпангине, цистите и боли в спине.
Лабораторная диагностика
Диагностика основывается в первую очередь на анамнезе и физикальном осмотре.
У большинства пациентов подтверждение диагноза с помощью лабораторных исследований обычно бесполезно, потому что большинство тестов требуют много времени, не обладают специфичностью или недоступны за пределами исследовательских учреждений. У отдельных групп пациентов картина может быть нетипичной и может потребовать дополнительного обследования.
Одним из наименее дорогих и простых методов лабораторной диагностики VZV и других герпесвирусов является тест Цанка, который подтверждает, что поражение является герпетическим, но не может отличить VZV от других герпесвирусов. Когда требуется срочное подтверждение диагноза, предпочтение отдается современным тестам, таким как ПЦР и прямой иммунофлюоресцентный анализ.
В типичных случаях кожной инфекции опоясывающего герпеса визуализирующие тесты не показаны. Магнитно-резонансная томография может использоваться в случаях миелопатии или энцефалопатии как средство исключения других этиологий.
У небольшого процента пациентов, особенно с поражением черепных нервов, могут развиться головная боль и ригидность затылочных мышц, что требует проведения люмбальной пункции для исключения менингита.
В редких случаях, когда необходима биопсия кожи, гистологические данные аналогичны таковым при простом герпесе и ветряной оспе. Баллонная дегенерация и акантолиз кератиноцитов приводят к образованию внутриэпидермальных пузырьков. Характерны многоядерные гигантские клетки с акцентом ядерного материала на периферии ядер. Лейкоцитокластический васкулит часто является заметным признаком и помогает дифференцировать опоясывающий лишай от других герпетических инфекций. Лимфоциты могут быть обнаружены в нижней части эпидермиса. Сосочковая дерма часто отечна. Распространенной находкой являются экстравазированные эритроциты в различных количествах. В верхних слоях дермы имеется выраженный лимфоцитарный инфильтрат. Некоторые из этих лимфоцитов могут иметь большие и полигональные ядра. Иногда встречаются нейтрофилы и ядерная пыль, эозинофилы встречаются редко.
Лечение
Эпизоды опоясывающего лишая обычно проходят самостоятельно и без лечения. Однако существуют некоторые эффективные методы лечения, которые могут уменьшить степень и продолжительность симптомов, а также, возможно, риск хронических осложнений (например, ПГН).
Существует множество местных методов лечения, включая 5% крем ацикловира для местного применения, лидокаин и капсаицин. Последний (если доступен), применяется не менее 5 раз в день и истощает нейротрансмиттеры в пораженных нервных окончаниях. Лидокаин для местного применения также можно использовать для лечения пациентов с ПГН. Также применяются влажно-высыхающие повязки со стерильным физиологическим раствором или жидкостью Бурова, которые следует накладывать на пораженные участки кожи на 30-60 мин. 4-6 раз в день. Лосьон Каламин, смесь оксида цинка и оксида железа, можно использовать в качестве противозудного средства. Он также используется в качестве мягкого антисептика для предотвращения инфекций, которые могут быть вызваны расчёсыванием поражённого участка, а также в качестве вяжущего средства при мокнущих или сочащихся волдырях. Впрочем, нет никаких доказательств того, что лосьон с каламином оказывает какое-либо реальное терапевтическое действие на сыпь и зуд.
Цели системного лечения — сокращения продолжительности болезни, обезболивание и предотвращение осложнений. Вопрос о том, являются ли стероиды необходимыми или даже полезными при лишае, остается предметом дискуссий. Многие практикующие врачи уже давно используют пероральный преднизолон и аналогичные препараты для уменьшения острой боли. Некоторые исследователи за счет применения стероидов также надеялись уменьшить заболеваемость ПГН, предположительно, за счёт уменьшения воспаления в ганглиях задних корешков и вовлеченных сенсорных нервах. В то время как некоторые исследования предоставили доказательства того, что раннее применение стероидов может снизить заболеваемость ПГН, другие исследования не показали положительного эффекта.
Большинство пациентов с опоясывающим герпесом испытывают боль, которая является наиболее изнурительным симптомом заболевания. Основные лекарства для лечения острой боли включают ненаркотические и наркотические анальгетики, нейроактивные средства (например, трициклические антидепрессанты), противосудорожные средства. Эффективность этих методов лечения общей невропатической боли хорошо известна, но лишь некоторые из них оценивались в контролируемых исследованиях конкретно при острой боли при опоясывающем лишае.
Многие исследования показали, что ацикловир и его производные (валацикловир, фамцикловир, пенцикловир и десцикловир) безопасны и эффективны при лечении активного заболевания и профилактике ПГН. Их механизм действия включает предотвращение репликации VZV посредством ингибирования вирусной ДНК-полимеразы. Валацикловир и фамцикловир не одобрены FDA для лечения опоясывающего герпеса у детей. В контролируемых исследованиях применения противовирусных препаратов оценивалась эффективность начала терапии только в течение 48-72 часов после появления сыпи. Несколько обсервационных исследований показали, что противовирусная терапия способна уменьшить боль при опоясывающем лишае, даже если она начата за пределами традиционного 72-часового терапевтического окна. Таким образом, противовирусная терапия должна рассматриваться в схемах лечения острого опоясывающего лишая, независимо от времени проявления. Исследования показали, что пероральный прием ацикловира, фамцикловира и валацикловира снижает выделение вируса и ускоряет исчезновение симптомов (например, боли) при неосложненном опоясывающем герпесе. Некоторые исследования показали, что валацикловир и фамцикловир могут превосходить ацикловир в устранении боли и ускорении заживления кожи. Кроме того, оба препарата обладают большей биодоступностью, чем ацикловир, и поэтому требуют более редкого приема. Кроме того, появляются устойчивые к ацикловиру вирусные штаммы, что предполагает потенциально возросшую роль других лекарств.
Профилактика
Высказывается предположение, что опоясывающий герпес возникает, когда титры антител и специфический к ветряной оспе клеточный иммунитет падают до уровня, при котором они больше не полностью эффективны для предотвращения вирусной активации. Доказательства этой гипотезы включают наблюдение, что у педиатров, которые предположительно регулярно подвергаются повторному воздействию вируса ветряной оспы и, таким образом, поддерживают высокий уровень иммунитета, редко развивается опоясывающий лишай.
Существует живая аттенуированная и рекомбинантная вакцины против ветряной оспы. Вакцинация детей привела к более низким показателям заболеваемости опоясывающим герпесом, чем у детей, инфицированных в результате естественного контакта с VZV.
Поскольку опоясывающий лишай у пожилых встречается чаще и связан с большим количеством осложнений, то профилактика особенно предпочтительны в этой группе населения. По данным рандомизированного двойного слепого плацебо-контролируемого испытания вакцины с участием более 38 000 взрослых старше 60 лет вакцинация снизила заболеваемость герпесом на 61,1% и заболеваемость ПГН на 66,5%.
Для пациентов с риском тяжелого заболевания и осложнений, таких как новорожденные и пациенты с ослабленным иммунитетом или беременные, может применяться герпес-зостерный иммуноглобулин, который обеспечивает максимальную пользу при скорейшем введении после предполагаемого контакта с заболевшим.
Во время острой фазы пациенты при прямом контакте пациенты заразны для тех, кто не болел ветряной оспой, для людей с ослабленным иммунитетом, для беременных.
Список литературы
- [Guideline] Dworkin RH, Johnson RW, Breuer J, Gnann JW, et al. Recommendations for the management of herpes zoster. Clin Infect Dis. 2007 Jan 1. 44 Suppl 1:S1-26.
- Blein C, Gavazzi G, Paccalin M, Baptiste C, Berrut G, Vainchtock A. Burden of herpes zoster: the direct and comorbidity costs of herpes zoster events in hospitalized patients over 50 years in France. BMC Infect Dis. 2015 Aug 19. 15 (1):350.
- Pavan-Langston D. Herpes zoster ophthalmicus. Neurology. 1995 Dec. 45(12 Suppl 8):S50-1.
- Sweeney CJ, Gilden DH. Ramsay Hunt syndrome. J Neurol Neurosurg Psychiatry. 2001 Aug. 71(2):149-54.
- Wung PK, Holbrook JT, Hoffman GS, Tibbs AK, Specks U, et al. Herpes zoster in immunocompromised patients: incidence, timing, and risk factors. Am J Med. 2005 Dec. 118(12):1416.
- Norman J, Politz D. Shingles (varicella zoster) outbreaks in patients with hyperparathyroidism and their relationship to hypercalcemia.
- Strangfeld A, Listing J, Herzer P, Liebhaber A, Rockwitz K, Richter C, et al. Risk of herpes zoster in patients with rheumatoid arthritis treated with anti-TNF-alpha agents. JAMA. 2009 Feb 18. 301(7):737-44.
- Sharma A, Makrandi S, Modi M, Sharma A, Marfatia Y. Immune reconstitution inflammatory syndrome. Indian J Dermatol Venereol Leprol. 2008 Nov-Dec. 74(6):619-21.
- Long MD, Martin C, Sandler RS, Kappelman MD. Increased risk of herpes zoster among 108 604 patients with inflammatory bowel disease. Aliment Pharmacol Ther. 2013 Feb. 37(4):420-9.
- Forbes HJ, Bhaskaran K, Thomas SL, Smeeth L, Clayton T, Langan SM. Quantification of risk factors for herpes zoster: population based case-control study. BMJ. 2014. 348:g2911.
- Marin M, Meissner HC, Seward JF. Varicella prevention in the United States: a review of successes and challenges. Pediatrics. 2008 Sep. 122(3):e744-51.
- Araújo LQ, Macintyre CR, Vujacich C. Epidemiology and burden of herpes zoster and post-herpetic neuralgia in Australia, Asia and South America. Herpes. 2007 Sep. 14 Suppl 2:40-4.
- Ultsch B, Köster I, Reinhold T, Siedler A, Krause G, Icks A, et al. Epidemiology and cost of herpes zoster and postherpetic neuralgia in Germany. Eur J Health Econ. 2012 Dec 28.
- Nagasako EM, Johnson RW, Griffin DR, Elpern DJ, Dworkin RH. Geographic and racial aspects of herpes zoster. J Med Virol. 2003. 70 Suppl 1:S20-3.
- Insinga RP, Itzler RF, Pellissier JM, Saddier P, Nikas AA. The incidence of herpes zoster in a United States administrative database. J Gen Intern Med. 2005 Aug. 20(8):748-53.
- Tseng HF, Smith N, Marcy SM, Sy LS, Chao CR, Jacobsen SJ. Risk factors of herpes zoster among children immunized with varicella vaccine: results from a nested case-control study. Pediatr Infect Dis J. 2010 Mar. 29(3):205-8.
- Kim MC, Yun SC, Lee HB, Lee PH, Lee SW, Choi SH, et al. Herpes Zoster Increases the Risk of Stroke and Myocardial Infarction. J Am Coll Cardiol. 2017 Jul 11. 70 (2):295-296.
- Matthews I, Duong M, Parsons VL, Nozad B, Qizilbash N, Patel Y, et al. Burden of disease from shingles and post-herpetic neuralgia in the over 80 year olds in the UK. PLoS One. 2020. 15 (2):e0229224.
- Makharita MY. Prevention of Post-herpetic Neuralgia from Dream to Reality: A Ten-step Model. Pain Physician. 2017 Feb. 20 (2):E209-E220.
- Ono N, Sakabe A, Nakajima M. [Herpes zoster oticus-associated jugular foramen syndrome]. Brain Nerve. 2010 Jan. 62(1):81-4.
- Kim YJ, Lee CN, Lee MS, Lee JH, Lee JY, Han K, et al. Recurrence Rate of Herpes Zoster and Its Risk Factors: a Population-based Cohort Study. J Korean Med Sci. 2019 Jan 14. 34 (2):e1.
- Fabian VA, Wood B, Crowley P, Kakulas BA. Herpes zoster brachial plexus neuritis. Clin Neuropathol. 1997 Mar-Apr. 16(2):61-4.
- Furuta Y, Fukuda S, Suzuki S, Takasu T, Inuyama Y, Nagashima K. Detection of varicella-zoster virus DNA in patients with acute peripheral facial palsy by the polymerase chain reaction, and its use for early diagnosis of zoster sine herpete. J Med Virol. 1997 Jul. 52(3):316-9.
- Hong JJ, Elgart ML. Gastrointestinal complications of dermatomal herpes zoster successfully treated with famciclovir and lactulose. J Am Acad Dermatol. 1998 Feb. 38(2 Pt 1):279-80.
- Koh MJ, Seah PP, Teo RY. Zosteriform herpes simplex. Singapore Med J. 2008 Feb. 49(2):e59-60.
- Patel GA, Siperstein RD, Ragi G, Schwartz RA. Zosteriform lymphangioma circumscriptum. Acta Dermatovenerol Alp Panonica Adriat. 2009 Dec. 18(4):179-82.
- Ozcan A, Senol M, Saglam H, Seyhan M, Durmaz R, Aktas E, et al. Comparison of the Tzanck test and polymerase chain reaction in the diagnosis of cutaneous herpes simplex and varicella zoster virus infections. Int J Dermatol. 2007 Nov. 46(11):1177-9.
- Böer A, Herder N, Blödorn-Schlicht N, Falk T. Herpes incognito most commonly is herpes zoster and its histopathologic pattern is distinctive!. Am J Dermatopathol. 2006 Apr. 28(2):181-6.
- Shrestha M, Chen A. Modalities in managing postherpetic neuralgia. Korean J Pain. 2018 Oct. 31 (4):235-243.
- Gelb LD. Preventing herpes zoster through vaccination. Ophthalmology. 2008 Feb. 115(2 Suppl):S35-8.
- Whitley RJ, Weiss H, Gnann JW Jr, Tyring S, Mertz GJ et al. Acyclovir with and without prednisone for the treatment of herpes zoster. A randomized, placebo-controlled trial. The National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group. Ann Intern Med. 1996 Sep 1. 125(5):376-83.
- Wood MJ, Shukla S, Fiddian AP, Crooks RJ. Treatment of acute herpes zoster: effect of early (< 48 h) versus late (48-72 h) therapy with acyclovir and valaciclovir on prolonged pain. J Infect Dis. 1998 Nov. 178 Suppl 1:S81-4.
- Lin PL, Fan SZ, Huang CH, Huang HH, Tsai MC, Lin CJ, et al. Analgesic effect of lidocaine patch 5% in the treatment of acute herpes zoster: a double-blind and vehicle-controlled study. Reg Anesth Pain Med. 2008 Jul-Aug. 33(4):320-5.
- Degreef H. Famciclovir, a new oral antiherpes drug: results of the first controlled clinical study demonstrating its efficacy and safety in the treatment of uncomplicated herpes zoster in immunocompetent patients. Int J Antimicrob Agents. 1994. 4(4):241-6.
- Beutner KR, Friedman DJ, Forszpaniak C, Andersen PL, Wood MJ. Valaciclovir compared with acyclovir for improved therapy for herpes zoster in immunocompetent adults. Antimicrob Agents Chemother. 1995 Jul. 39(7):1546-53.
- Wood MJ, Johnson RW, McKendrick MW, Taylor J, Mandal BK, Crooks J. A randomized trial of acyclovir for 7 days or 21 days with and without prednisolone for treatment of acute herpes zoster. N Engl J Med. 1994 Mar 31. 330(13):896-900.
- Strasfeld L, Chou S. Antiviral drug resistance: mechanisms and clinical implications. Infect Dis Clin North Am. 2010 Sep. 24(3):809-33.
- Decroix J, Partsch H, Gonzalez R, Mobacken H, Goh CL, Walsh L, et al. Factors influencing pain outcome in herpes zoster: an observational study with valaciclovir. Valaciclovir International Zoster Assessment Group (VIZA). J Eur Acad Dermatol Venereol. 2000 Jan. 14(1):23-33.
- Kim M, Han K, Yoo SA, Lee JH. Herpes Zoster and Subsequent Cancer Risk: A Nationwide Population-Based Cohort Study in Korea. Dermatology. 2021. 237 (1):73-78.
- Oxman MN, Levin MJ, Johnson GR, Schmader KE, et al. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. N Engl J Med. 2005 Jun 2. 352(22):2271-84.
- Oxman MN. Zoster vaccine: current status and future prospects. Clin Infect Dis. 2010 Jul 15. 51(2):197-213.
- Civen R, Chaves SS, Jumaan A, Wu H, Mascola L, Gargiullo P, et al. The incidence and clinical characteristics of herpes zoster among children and adolescents after implementation of varicella vaccination. Pediatr Infect Dis J. 2009 Nov. 28(11):954-9.
- Caple J. Varicella-zoster virus vaccine: a review of its use in the prevention of herpes zoster in older adults. Drugs Today (Barc). 2006 Apr. 42(4):249-54.
- van Hoek AJ, Gay N, Melegaro A, Opstelten W, Edmunds WJ. Estimating the cost-effectiveness of vaccination against herpes zoster in England and Wales. Vaccine. 2009 Feb 25. 27(9):1454-67.
- [Guideline] CDC. Recommended Immunization Schedule for Adults Aged 19 Years or Older, United States 2018. Centers for Disease Control and Prevention. February 6, 2018.
- [Guideline] Fashner J, Bell AL. Herpes zoster and postherpetic neuralgia: prevention and management. Am Fam Physician. 2011 Jun 15. 83 (12):1432-7.