Одним из частых поводов обращения пациенток (женщины традиционно более внимательно относятся к своему здоровью) ко мне является появление необычного рубца или «твёрдой родинки» на ногах. Также весьма характерны и опасения в отношение возможности возникновения рака кожи. Эти уплотнения, как правило, оказываются дерматофибромами — доброкачественными образованиями.
Дерматофибромы обычно растут медленно и большинство из них представляют собой одиночный узелок на конечностях, но это не исключает вероятности их появления на любом участке кожи. Они являются самыми частыми болезненными опухолями кожи, приводящими пациента на приём. Чаще всего этими пациентами (и не только у меня, а по всему миру) являются женщины, которые бреют ноги и могут быть обеспокоены травмированием их бритвой и, как следствие, болью, кровотечением, эрозивными изменениями и изъязвлением. Быстрый рост не характерен для дерматофибром и они обычно остаются без изменений десятилетиями. Пациенты обычно жалуются на плотную родинку или необычный рубец, и часто обеспокоены возможностью возникновения рака кожи.
Обычно дерматофибромы не требуют никакого лечения. Только при подозрении на агрессивные типы требуется удаление и подтверждение доброкачественности процесса. Хирургическое удаление применимо в случае косметических показаний или в случае неоднозначной клинической картины. Биопсия в виде перевернутой пирамиды позволяет получить и положительный эстетический результат, и достаточное количество тканей для гистологического анализа. Поверхностное удаление или криодеструкция может дать хорошие эстетические результаты или уменьшить симптомы; но в этих случаях велика вероятность рецидива. Также для удаления дерматофибром используются углекислый лазер и лазер на красителях.
Если дерматофиброма меняется в цвете, размере, границах или появляются неприятные ощущения, то пациенту рекомендуется приходить на периодический осмотр. Если после удаления дерматофибромы возник рецидив, то это повод обращения ко врачу. При появлении множественных, сгруппированных дерматофибром следует проанализировать семейный анамнез и исключить тяжелые фоновые заболевания. При агрессивных типах дерматофибром следует исключить злокачественный процесс.
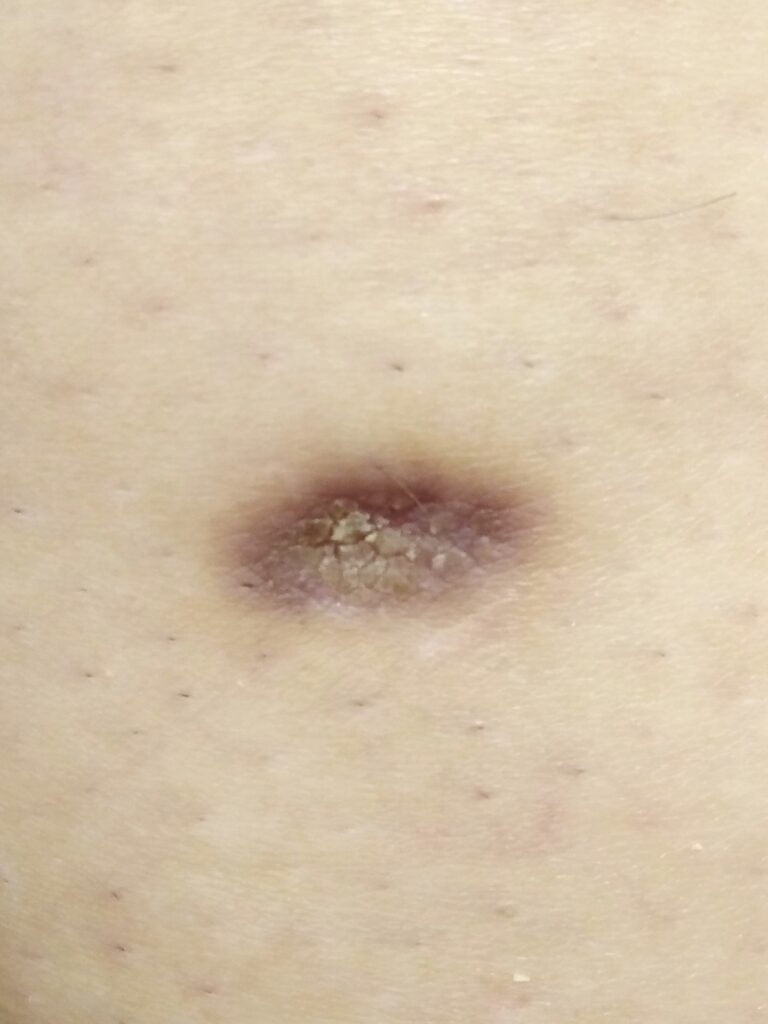
Мне памятны 2 дерматофибромы, которые выделяются на фоне сотен увиденных дерматофибром. В одном случае это была западающая (атрофичекая) дерматофиброма, возникшая более 30 лет назад на фоне воспаления и сохранившаяся с тех пор в неизменном виде. Удаления она не требовала и с эстетической точки зрения пациентку не беспокоила.
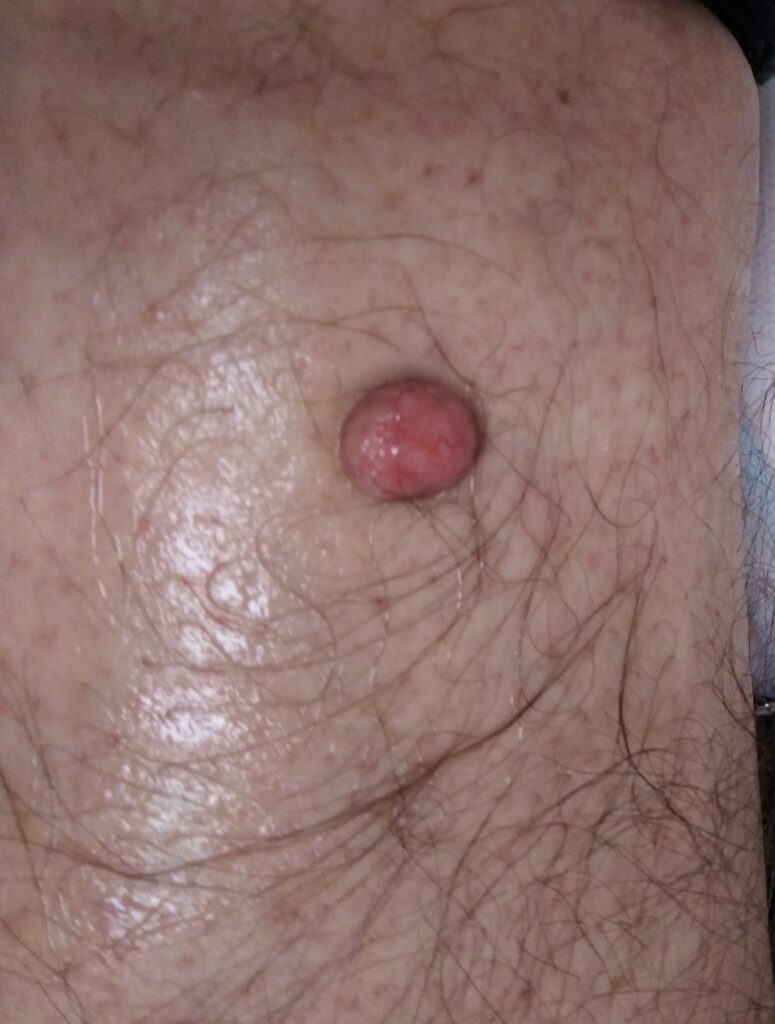
Второй была заметно выступающая над уровнем кожи (полипоидная) дерматофиброма у мужчины. Дерматофиброма существовала более 10 лет в неизменном виде, но её наличие беспокоило пациента, что и стало причиной её удаления. Проведение гистологического исследования было само собой разумеющимся.
Общая информация
Дерматофиброма (поверхностная доброкачественная фиброзная гистиоцитома) — часто встречающиеся кожная опухоль неизвестной природы, которая возникает чаще всего у женщин. Дерматофиброма часто развивается на руках и ногах, и изредка может давать о себе знать слабым зудом и дискомфортом. Удаление опухолей обычно не требуется и к нему прибегают при не очевидном диагнозе или при появлении беспокоящих симптомов.
Как правило дерматологи сталкиваются с первично кожной (поверхностной) дерматофибромой. Подкожная (глубокая) доброкачественная гистиоцитома бывает редким поводом для обращения, чаще всего с ней имеют дело хирурги и онкологи. Внимание и подробное исследование последней связано с тем, что она может иметь агрессивное клиническое течение и гистологически иметь различные варианты: клеточный, аневризмальный и атипичный. Кроме того доброкачественные фиброзные гистиоцитомы описаны в костях, глазницах, дыхательных путях, желудочно-кишечном тракте, селезенке, мочеполовой системе и внутри черепа.
На коже у одного пациента возможно наличие нескольких дерматофибром, но редко когда их число превышает 15. Множественный эруптивный вариант возникает лишь у 1% пациентов, и примерно 60% из них имеют тяжелое фоновое состояние, как например ВИЧ-инфекция или системная красная волчанка. Также описаны случаи сочетания множественных дерматофибром с дерматомиозитом, болезнью Грейвса, тиреоидитом Хашимото, миастенией гравис, синдромом Дауна, лейкемией, миелодиспластическим синдромом, кожной Т-клеточной лимфомой, множественной миеломой, атопическим дерматитом, болезнью Крона и язвенным колитом. Также описана взаимосвязь их появления с приёмом лекарственных средств, среди которых антиретровирусные агенты, биологический препарат эфализумаб, антитела к фактору некроза опухоли альфа и ингибитор тирозиновой киназы иматиниб. Описаны также врождённые и приобретённые случаи множественных сгруппированных дерматофибром.
Этиология
Исторические дерматофиброму принято считать реактивным процессом на некоторые повреждения кожи (укус насекомых, татуировка, туберкулиновый тест, предшествующий фолликулит), но точные причины неизвестны. Клональный анализ предполагает, что она представляет собой истинную неоплазму. Измененный иммунитет, вероятно, играет роль во многих случаях множественных эруптивных дерматофибром, связанных с различными фоновыми состояниями и приемом лекарствам (описано выше). Изучение эруптивных дерматофибром у родственников предполагает существование генетического компонента.
Патофизиология
Точный механизм развития дерматофибромы неизвестен. В последнее время гипотеза вероятного реактивного изменения ткани уступает доказательствам опухолевого процесса что, демонстрируется её клональным пролиферативным ростом. Клональность сама по себе не является синонимом неопластического процесса; она может быть выявлена и при воспалительных процессах, включая атопический дерматит, атрофический лишай и псориаз. Возможную связь образования дерматофибромы связывают с нарушением активности протеинкиназы С. По результатам иммуногистохимического исследования (ИГХ) с антителами к фактору XIIIа, который является меткой дермальных дендритных клеток, дерматофибромы оказываются часто позитивны, в то время как антитела к MAC 387, который является маркером моноцитов, произошедшим из макрофагов (гистиоцитов), показывает не столь однозначные результаты. Одно из исследований оценивало экспрессию в дерматофиброме HSP47 (маркера кожных фибробластов), CD68 (маркера гистиоцитов) и фактора XIIIа. Большинство веретенообразных клеток во всех 28 случаях дерматофибромы, независимо от гистологического варианта, были окрашены положительно HSP47, что являлось доказательством, что кожные фибробласты — основной компонент дерматофибромы. Имели место также позитивные в отношение фактора XIIIа дендритные клетки, но наличие CD68-позитивных гистоцитов было непостоянным, особенно в различных гистологических вариантах.
В росте дерматофибром играют роль ряд молекул — поверхностный протеогликан, синдекан-1 и фактор роста фибробластов-2, участвующие в эпителиально-мезенхимальной передаче сигнала. Сигналинг трансформирующего фактора роста бета (ТФР-b) может быть триггером фиброза, наблюдаемого в дерматофибромах. ТФР-b наряду с другими фибриногенными факторами, может продуцироваться тучным клеткам, о наличии которых в аномально большом количестве в дерматофибромах, сообщают некоторые исследователи.
Также ряд исследователей сообщают об обнаружении генных слияний в дерматофиброме, а также о генной перестройке и избыточной экспрессии гена ALK в эпителиоидных и атипичных дерматофибромах.
Эпидемиология
Дерматофибромы встречаются относительно часто. Не имеет расовой предрасположенности. У женщины дерматофибромы встречаются 2 раза чаще, чем у мужчин. Дерматофибромы могут возникать в любом возрасте. В одном исследовании 80% биопсий было сделано в возрасте 20-49 лет, а в другом — средний возраст был равен 42,18±13,72.
Физикальный осмотр
Обычно клинические проявления дерматофибромы — одиночный, диаметром 0,5-1 см узелок. Подавляющее меньшинство пациентов имеет несколько дерматофибром, но редко (<1% случаев) встречается более 15 поражений. Кожа вокруг и на дерматофиброме может быть разных цветов: светло-серый, желтый, оранжевый, розовый, красный, пурпурный, голубой, коричневый или черный, возможно сочетание оттенков. При пальпации плотный узел может напоминать маленький камень, прикрепленный к поверхности кожи и свободно двигающийся в подкожной клетчатке. Пальпация может сопровождаться неприятными ощущениями. Характерное углубление покрывающего и прилегающего эпидермиса при латеральном сдавлении называется “симптомом звонка” (или симптомом Фитцпатрика) может быть полезным клиническим симптомом. Но наличие “симптома звонка” характерно не только для дерматофибромы. Дерматоскопия может быть полезна в дополнении к клиническому осмотру.
Ноги — самое частое место возникновения дерматофибром. Хотя они могут появиться на любом участке кожи, ладони, подошвы, пальцы, рот и гениталии поражаются редко. Не стоит забывать о редких формах — гигантских (более 5 см в диаметре), атрофических, полипоидных и дерматофибромах с распространяющимися сателлитами. Самая большая зафиксированная дерматофиброма — 17х9х4см. Множественные сгруппированные дерматофибромы редки и могут быть схожи с выбухающей дерматофибросаркомой. Сгруппированные дерматофибромы обычно наблюдаются в одном дерматоме. В научной литературе описан 1 случай гало-дерматита (феномена Мейерсона) вокруг дерматофибромы.
Дифференциальный диагноз
Кожная хондрома, десмопластическая трихоэпителиома, гранулема инородного тела, опухоль Абрикосова, нодулярный фасциит, нодулярная чесотка, нейротекома, киста желточного протока, нейрофиброма, дерматомиофиброма, эпителиоидная саркома.
Инструментальные исследования
При УЗИ дерматофибромы представляют собой гипоэхогенный солидный узелок. Дерматофибромы могут быть выявлены по результатам оптической когерентной томографии. При ПЭТ дерматофиброма может мимикрировать со злокачественными опухолями. Для владеющих дерматоскопией она может быть полезным дополнительным методом выявления дерматофибром. Наиболее часто наблюдается периферическая пигментная сеть с центральной белой областью. При дерматоскопии ксантоматозной дерматофибромы наблюдается гомогенный паттерн с оттенками желтого цвета и периферической пигментной сетью. Зеленый цвет может указывать на сидеропенический вариант опухоли. Если при дерматоскопии наблюдается меланоцитарный или атипичный паттерн, то показана биопсия. Если имеют место диагностические затруднения, то показана эксцизионная биопсия до подкожной жировой клетчатки.
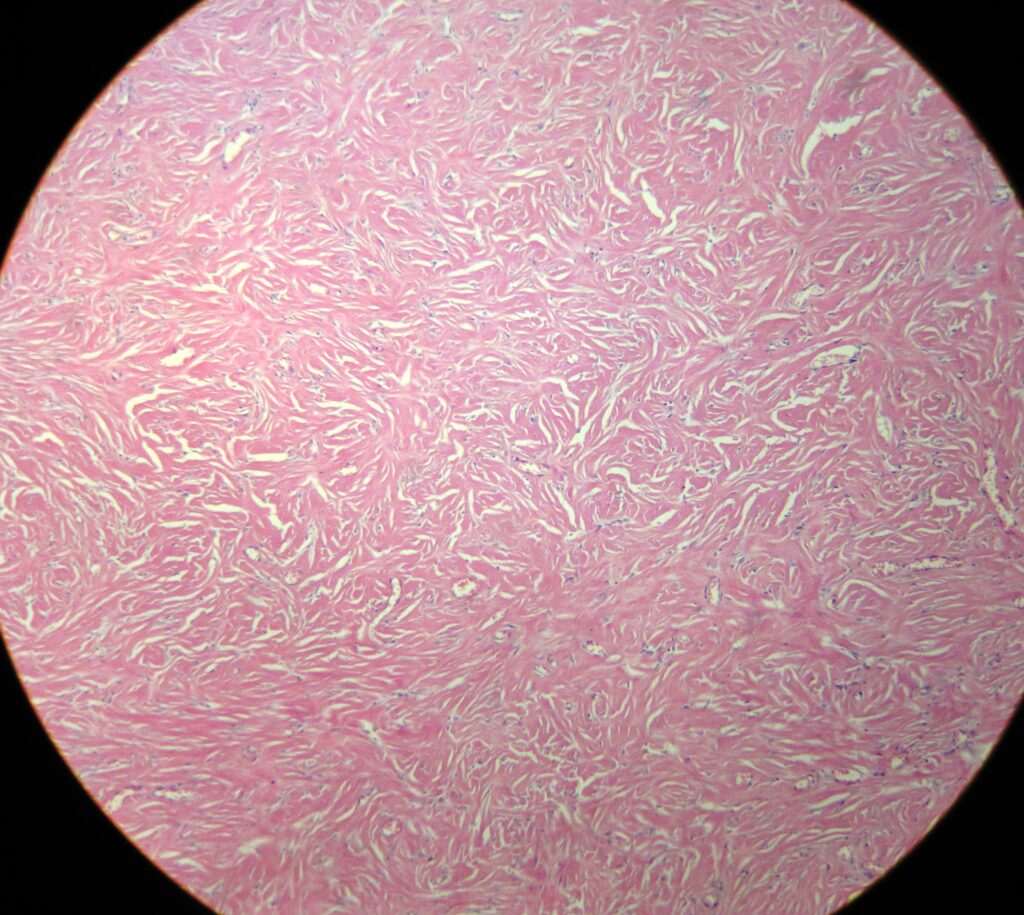
Гистологическое исследование
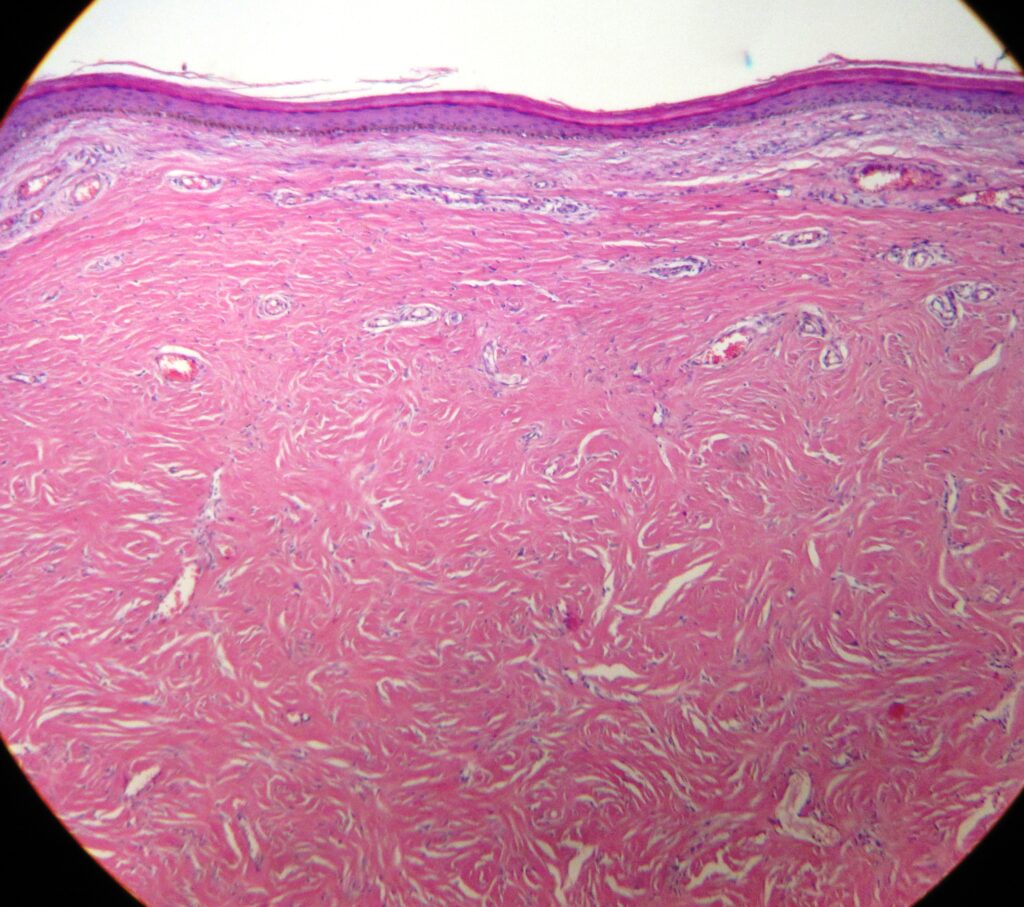
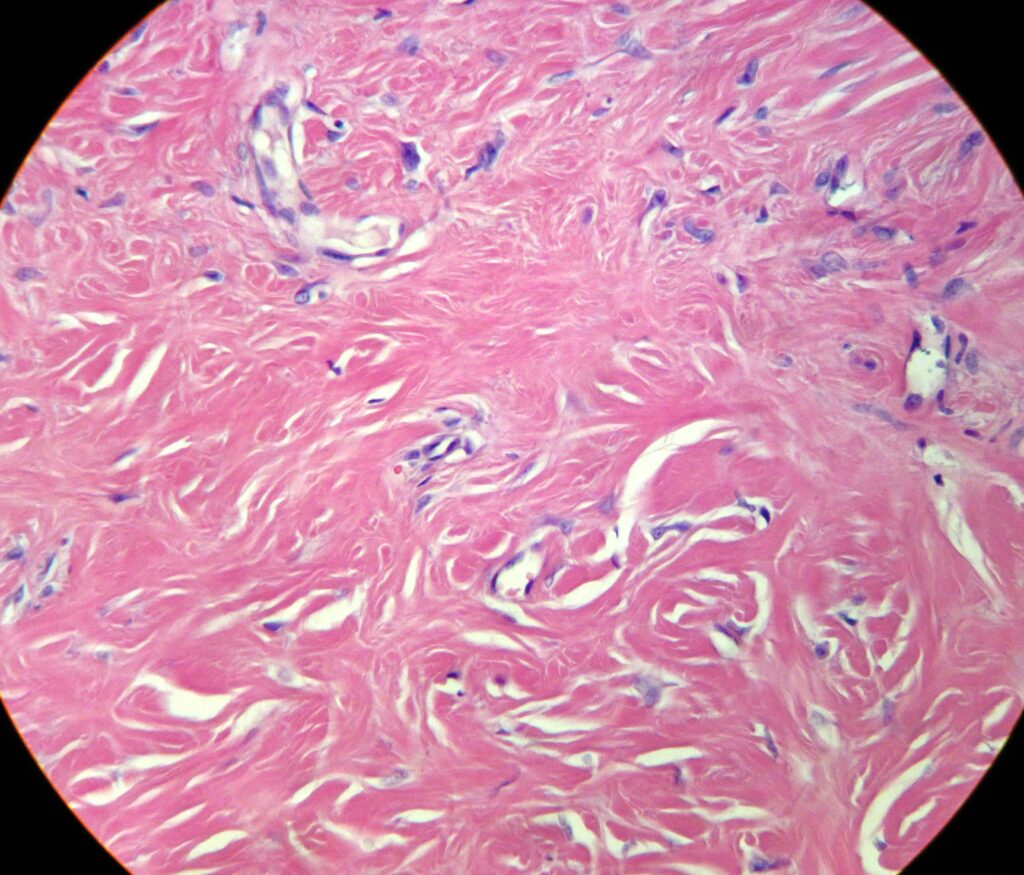
Эпителий, покрывающий дерматофиброму, обычно акантотичен. Наблюдается псевдоэпителиоматозная гиперплазия и базалоидная пролиферация. Гиперплазия может быть связана с действием фибробластов на эпидермальные кератиноциты. Может наблюдаться повышенное содержание пигмента, который может быть железом или меланином. В большинстве высыпаний наблюдается зона Гренца в сосочковом слое дермы, покрывающем опухоль. Основная масса опухоли располагается без капсулы в толще дермы, а периферия опухоли сливается с окружающей тканью. Характерны извитые пучки пролиферирующих веретенообразных клеток с чрезмерным отложением коллагена. На периферии веретеновидные клетки характерным образом оборачиваются пучками нормального коллагена. Существуют наблюдения о вкраплении меланоцитов среди веретеновидных клеток. Подкожная жировая клетчатка обычно интактна, но в случае поражения следует исключить выбухающую дерматофибросаркому (ВДФС).
Антитела к фактору XIIIa и СD 34 полезны для дифференцировки этих 2 опухолей: первое указывает на дерматофиброму, второе — на ВДФС. CD34 позитивный ответ также имеет место при клеточном варианте дерматофибромы. Дерматофибромы сохраняют эластичные волокна, в то время как при ВДФС они фрагментированы или смещены. Это можно оценить при флюоресцентной микроскопии образцов, окрашенных гематоксилином и эозином, или при окраске на эластичные волокна.
Для дифференцировке эти двух опухолей может быть полезно выявление некоторых молекул: для дерматофибромы характерна секреция стромелизина-3, тромбоспондин-1 и связанный с ним ТФР-b аблюдаются вповышенном количестве в ВДФС, нестин экспрессируется только в 13% дерматофибром и в 94% ВДФС.
Для дифференцировки дерматофибромы от ВДФС может быть полезен FISH анализ.
Одна клинико-патологическая классифицирующая схема описывает следующие четыре категории дерматофибромы: 1) с архитектурными особенностями, такими как глубокое проникновение, атрофический, аневризмальный (ангиоматоидный), гемангиоперицитома-подобный, палиссадный или оссифицирующий варианты; 2) клеточные/стромальные дерматофибромы, такие как светлоклеточная, зернистоклеточная, миофибробластическая, склеротическая, атипичная (псевдосаркоматозная), гемосидеротическая, холестериновая (липидная) и миксоидная варианты; холестериновый вариант описан при метаболическом синдроме, наиболее вероятно холестерин возникает из разрушенных клеточных мембран, нежели проникает из циркулирующих липопротеидов; 3) дерматофибромы с архитектурными и клеточными/стромальными изменениями в гомогенном окружении; 4) сложная, составная или комбинированная дерматофиброма с 2 и более архитектурными и клеточными/стромальными паттернами в одном образовании.
Гистологическое исследование 192 дерматофибром выявило 80% общих фибром, 5,7% аневризмальных, 2,6% эпителиоидных, 2,1% клеточных, 2,1% липидных, 1% атрофических и 0,5% светлоклеточных.
Существует предположение, что эпителиодная дерматофиброма является отдельной опухолью, основывающееся на том факте, что в одном исследовании маркер CD10 был положителен в 11 из 11 дерматофибром и только в 1 из 7 эпителиодных дерматофибром.
Описаны редкие гистологические наблюдения дерматофибром: изъязвленная и эрозивная дерматофибромы, дерматофиброма с эозинофильным инфильтратом, ассоциированная с перфорирующим дерматозом, с сальной гиперплазией, с интрацитоплазматическими эозинофильными глобулами, с перстневидными клетками, с отложениями легких цепей амилоида и со случайным акантолизом. При дерматофибромах часто зафиксирована индукция гиперплазии рядом расположенных структур. В исследовании более 10000 дерматофибром наблюдалась ассоциированная индукция фолликулярных структур и структур сальной железы. Дерматофибромы плеча имеют высокую частоту сальной индукции и гиперплазией похожей на себорейный кератоз.
Возможно редкое сосуществование дерматофибромы и меланоцитарных образований в одном образце. В опубликованном исследовании на эту тему были продемонстрированы юнкционный, дермальный и сложный невусы, а также один случай меланомы in situ. Знания этих взаимоотношений могут помочь предотвратить неправильный диагноз, положительное ИГХ с маркерами S-100 и Mart-1 говорит в пользу меланоцитарного образования, с XIIIа — в пользу дерматофибромы. Другой возможный маркер — SOX10, положительный в меланоцитарных образованиях, но не в фиброгистиоцитарных. Для дифференциальной диагностики дерматофибром с эпителиодными саркомами применяют маркер INI-1, наблюдаемый в 100% дерматофибром и отсутствующий в большинстве эпителиодных сарком.
Прогноз
Типичные поверхностные дерматофибромы считаются доброкачественными образованиями с хорошим прогнозом. Лишь у небольшого количества пациентов может возникать дискомфорт от болезненности и значительного зуда.
Сложности могут возникнуть при глубоких, клеточных, аневризмальных (гемосидеротических) и атипичных вариантах, которые склонны к местными рецидивам (до 20%) и редкому метастазированию. Такие варианты или любые другие неопределенные дерматофибромы могут быть расценены, как потенциально злокачественные опухоли. В этих особых случаях чаще всего наблюдались метастазы в лёгких и лимфоузлах, наличие множественных сателлитных узлов могут представлять угрозу для жизни. Согласно исследованиям способностью к метастазированию обладает эпителиодный вариант дерматофибромы, хотя тот факт, что в ней находят реаранжировку в гене ALK, может указывать её отдельную биологическую опухоль. При исследовании типичных дерматофибром с повышенным митотическим уровнем, но без других тревожных признаков, рецидивирование или метастазирование отсутствовало. Есть единичные сообщения о спонтанной регрессии дерматофибром с появлением поствоспалительной гипопигментации.
Список литературы:
- Naversen DN, Trask DM, Watson FH, Burket JM. Painful tumors of the skin: «LEND AN EGG». J Am Acad Dermatol. 1993 Feb. 28(2 Pt 2):298-300. [Medline].
- Chen TC, Kuo T, Chan HL. Dermatofibroma is a clonal proliferative disease. J Cutan Pathol. 2000 Jan. 27(1):36-9. [Medline].
- Plaszczyca A, Nilsson J, Magnusson L, Brosjö O, Larsson O, Vult von Steyern F, et al. Fusions involving protein kinase C and membrane-associated proteins in benign fibrous histiocytoma. Int J Biochem Cell Biol. 2014 Apr 8. [Medline].
- Kuroda K, Tajima S. Proliferation of HSP47-positive skin fibroblasts in dermatofibroma. J Cutan Pathol. 2008 Jan. 35(1):21-6. [Medline].
- Jin SY, Choi JS, Choi YL, Choi YL, Kim do H, Lee SH. Identification of leukocyte-specific protein 1-positive cells: a clue to the cell of origin and a marker for the diagnosis of dermatofibroma. Ann Dermatol. 2015 Apr. 27 (2):157-62. [Medline].
- Sellheyer K, Smoller BR. Dermatofibroma: upregulation of syndecan-1 expression in mesenchymal tissue. Am J Dermatopathol. 2003 Oct. 25(5):392-8. [Medline].
- Kubo M, Ihn H, Yamane K, Tamaki K. The expression levels and the differential expression of transforming growth factor-beta receptors in dermatofibroma and dermatofibrosarcoma protuberans. Br J Dermatol. 2006 May. 154(5):919-25. [Medline].
- Yamamoto T. Dermatofibroma: a possible model of local fibrosis with epithelial/mesenchymal cell interaction. J Eur Acad Dermatol Venereol. 2009 Apr. 23(4):371-5. [Medline].
- Walther C, Hofvander J, Nilsson J, Magnusson L, Domanski HA, Gisselsson D, et al. Gene fusion detection in formalin-fixed paraffin-embedded benign fibrous histiocytomas using fluorescence in situ hybridization and RNA sequencing. Lab Invest. 2015 Sep. 95 (9):1071-6. [Medline].
- Doyle LA, Mariño-Enriquez A, Fletcher CD, Hornick JL. ALK rearrangement and overexpression in epithelioid fibrous histiocytoma. Mod Pathol. 2015 Jul. 28 (7):904-12. [Medline].
- Szablewski V, Laurent-Roussel S, Rethers L, Rommel A, Van Eeckhout P, Camboni A, et al. Atypical fibrous histiocytoma of the skin with CD30 and p80/ALK1 positivity and ALK gene rearrangement. J Cutan Pathol. 2014 Sep. 41 (9):715-9. [Medline].
- Evans J, Clarke T, Mattacks CA, Pond CM. Dermatofibromas and arthropod bites: is there any evidence to link the two?. Lancet. 1989 Jul 1. 2(8653):36-7. [Medline].
- Lobato-Berezo A, Churruca-Grijelmo M, Martínez-Pérez M, Imbernón-Moya A, Vargas-Laguna ME, Fernández-Cogolludo E, et al. Dermatofibroma Arising within a Black Tattoo. Case Rep Dermatol Med. 2014. 2014:745304. [Medline].
- Watanabe K, Fukuda H, Niiyama S, Oharasaki T, Mukai H. Multiple dermatofibromas subsequent to folliculitis. Eur J Dermatol. 2013 Nov-Dec. 23 (6):890-1. [Medline].
- Nomura E, Yamamoto T. Photoletter to the editor: Fibrous histiocytoma developing at the site of tuberculin skin test. J Dermatol Case Rep. 2012 Dec 31. 6 (4):130-1. [Medline].
- Samlaska C, Bennion S. Eruptive dermatofibromas in a kindred. Cutis. 2002 Mar. 69(3):187-8, 190. [Medline].
- Han TY, Chang HS, Lee JH, Lee WM, Son SJ. A clinical and histopathological study of 122 cases of dermatofibroma (benign fibrous histiocytoma). Ann Dermatol. 2011 May. 23(2):185-92. [Medline].
- Şenel E, Yuyucu Karabulut Y, Doğruer Şenel S. Clinical, histopathological, dermatoscopic and digital microscopic features of dermatofibroma: a retrospective analysis of 200 lesions. J Eur Acad Dermatol Venereol. 2015 Oct. 29 (10):1958-66. [Medline].
- Kaddu S, McMenamin ME, Fletcher CD. Atypical fibrous histiocytoma of the skin: clinicopathologic analysis of 59 cases with evidence of infrequent metastasis. Am J Surg Pathol. 2002 Jan. 26(1):35-46. [Medline].
- Gleason BC, Fletcher CD. Deep «benign» fibrous histiocytoma: clinicopathologic analysis of 69 cases of a rare tumor indicating occasional metastatic potential. Am J Surg Pathol. 2008 Mar. 32(3):354-62. [Medline].
- Szumera-Cieckiewicz A, Ptaszynski K. Benign fibrous histiocytoma of the skin metastasizing to the inguinal lymph node. Pol J Pathol. 2011 Sep. 62(3):183-6. [Medline].
- Kimyai-Asadi A, Goldberg LH, Greenberg C, et al. Cellular, atypical, and indeterminate dermatofibromas: benign or malignant?. Dermatol Surg. 2008 Sep. 34(9):1264-71; discussion 1271-2. [Medline].
- Doyle LA, Fletcher CD. Metastasizing «benign» cutaneous fibrous histiocytoma: a clinicopathologic analysis of 16 cases. Am J Surg Pathol. 2013 Apr. 37 (4):484-95. [Medline].
- Massone C, Parodi A, Virno G, Rebora A. Multiple eruptive dermatofibromas in patients with systemic lupus erythematosus treated with prednisone. Int J Dermatol. 2002 May. 41(5):279-81. [Medline].
- García-Millán C, Aldanondo I, Fernández-Lorente M, Carrillo R, Jaén P. [Multiple eruptive dermatofibromas in 2 patients infected with the human immunodeficiency virus]. Actas Dermosifiliogr. 2007 Dec. 98(10):702-6. [Medline].
- Marque M, Pallure V, Huet P, Bessis D, Guillot B. [Multiple familial «eruptive» dermatofibromas]. Ann Dermatol Venereol. 2013 Jun-Jul. 140 (6-7):452-4. [Medline].
- Huang PY, Chu CY, Hsiao CH. Multiple eruptive dermatofibromas in a patient with dermatomyositis taking prednisolone and methotrexate. J Am Acad Dermatol. 2007 Nov. 57(5 Suppl):S81-4. [Medline].
- Lopez N, Fernandez A, Bosch RJ, Herrera E. Multiple eruptive dermatofibromas in a patient with Graves-Basedow disease. J Eur Acad Dermatol Venereol. 2008 Mar. 22(3):402-3. [Medline].
- Kimura Y, Kaneko T, Akasaka E, Nakajima K, Aizu T, Nakano H, et al. Multiple eruptive dermatofibromas associated with Hashimoto’s thyroiditis and myasthenia gravis. Eur J Dermatol. 2010 Jul-Aug. 20(4):538-9. [Medline].
- Monteagudo B, Suarez-Amor O, Cabanillas M, et al. [Down syndrome: another cause of immunosuppression associated with multiple eruptive dermatofibromas?]. Dermatol Online J. 2009 Sep 15. 15(9):15. [Medline].
- Alexandrescu DT, Wiernik PH. Multiple eruptive dermatofibromas occurring in a patient with chronic myelogenous leukemia. Arch Dermatol. 2005 Mar. 141(3):397-8. [Medline].
- Bhattacharjee P, Umar SA, Fatteh SM. Multiple eruptive dermatofibromas occurring in a patient with myelodysplastic syndrome. Acta Derm Venereol. 2005. 85(3):270-1. [Medline].
- Zaccaria E, Rebora A, Rongioletti F. Multiple eruptive dermatofibromas and immunosuppression: report of two cases and review of the literature. Int J Dermatol. 2008 Jul. 47(7):723-7. [Medline].
- Yazici AC, Baz K, Ikizoglu G, Koca A, Kokturk A, Apa DD. Familial eruptive dermatofibromas in atopic dermatitis. J Eur Acad Dermatol Venereol. 2006 Jan. 20(1):90-2. [Medline].
- Beyazit Y, Caner S, Kurt M, Kekilli M, Aydog G, Ibis M. Dermatofibroma in a patient with Crohn’s disease: a novel clinical manifestation. J Crohns Colitis. 2010 Oct. 4(4):490-1. [Medline].
- Hiraiwa T, Hanami Y, Yamamoto T. Hidradenitis suppurativa and multiple dermatofibromas in a patient with ulcerative colitis. J Dermatol. 2013 Dec. 40 (12):1071-2. [Medline].
- Bachmeyer C, Cordier F, Blum L, Cazier A, Vérola O, Aractingi S. Multiple eruptive dermatofibromas after highly active antiretroviral therapy. Br J Dermatol. 2000 Dec. 143(6):1336-7. [Medline].
- Santos-Juanes J, Coto-Segura P, Mallo S, Galache C, Soto J. Multiple eruptive dermatofibromas in a patient receiving efalizumab. Dermatology. 2008. 216(4):363. [Medline].
- Caldarola G, Bisceglia M, Pellicano R. Multiple eruptive plaque-like dermatofibromas during anti-TNFa treatment. Int J Dermatol. 2013 May. 52(5):638-41. [Medline].
- Llamas-Velasco M, Fraga J, Solano-López GE, Steegmann JL, García Diez A, Requena L. Multiple eruptive dermatofibromas related to imatinib treatment. J Eur Acad Dermatol Venereol. 2014 Jul. 28 (7):979-81. [Medline].
- Finch J, Berke A, McCusker M, Chang MW. Congenital Multiple Clustered Dermatofibroma in a 12-Year-Old Girl. Pediatr Dermatol. 2011 Dec 30. [Medline].
- Gershtenson PC, Krunic AL, Chen HM. Multiple clustered dermatofibroma: case report and review of the literature. J Cutan Pathol. 2010 Sep. 37(9):e42-5. [Medline].
- Meffert JJ, Peake MF, Wilde JL. Dimpling’ is not unique to dermatofibromas. Dermatology. 1997. 195(4):384-6. [Medline].
- Requena L, Farina MC, Fuente C, et al. Giant dermatofibroma. A little-known clinical variant of dermatofibroma. J Am Acad Dermatol. 1994 May. 30(5 Pt 1):714-8. [Medline].
- Ohnishi T, Sasaki M, Nakai K, Watanabe S. Atrophic dermatofibroma. J Eur Acad Dermatol Venereol. 2004 Sep. 18(5):580-3. [Medline].
- Kai H, Fujita H, Yamamoto M, Asahina A. Letter: Polypoid dermatofibroma with a slim pedicle: A case report. Dermatol Online J. 2012 Mar 15. 18(3):16. [Medline].
- Curco N, Jucgla A, Bordas X, Moreno A. Dermatofibroma with spreading satellitosis. J Am Acad Dermatol. 1992 Dec. 27(6 Pt 1):1017-9. [Medline].
- Kalsi H, Rahman A, Harbol T, Sidhu J. Giant Hemosiderotic Dermatofibroma: The Largest Giant Dermatofibroma Reported to Date. Am J Dermatopathol. 2015 Oct. 37 (10):778-82. [Medline].
- Schofield C, Weedon D, Kumar S. Dermatofibroma and halo dermatitis. Australas J Dermatol. 2012 May. 53(2):145-7. [Medline].
- Zaballos P, Puig S, Llambrich A, Malvehy J. Dermoscopy of dermatofibromas: a prospective morphological study of 412 cases. Arch Dermatol. 2008 Jan. 144(1):75-83. [Medline].
- Cavicchini S, Tourlaki A, Tanzi C, Alessi E. Dermoscopy of solitary yellow lesions in adults. Arch Dermatol. 2008 Oct. 144(10):1412. [Medline].
- Roldán-Marín R, Barreiro-Capurro A, García-Herrera A, Puig S, Alarcón-Salazar I, Carrera C, et al. Green colour as a novel dermoscopic finding in the diagnosis of haemosiderotic dermatofibroma. Australas J Dermatol. 2013 Jul 19. [Medline].
- Ferrari A, Argenziano G, Buccini P, Cota C, Sperduti I, De Simone P, et al. Typical and atypical dermoscopic presentations of dermatofibroma. J Eur Acad Dermatol Venereol. 2013 Nov. 27(11):1375-80. [Medline].
- Goldblum JR, Tuthill RJ. CD34 and factor-XIIIa immunoreactivity in dermatofibrosarcoma protuberans and dermatofibroma. Am J Dermatopathol. 1997 Apr. 19(2):147-53. [Medline].
- Volpicelli ER, Fletcher CD. Desmin and CD34 positivity in cellular fibrous histiocytoma: an immunohistochemical analysis of 100 cases. J Cutan Pathol. 2012 Aug. 39 (8):747-52. [Medline].
- John AM, Holahan HH, Singh P, Handler MZ, Lambert WC. When Immunohistochemistry Deceives Us: The Pitfalls of CD34 and Factor XIIIa Stains in Dermatofibroma and Dermatofibrosarcoma Protuberans. Skinmed. 2017. 15 (1):53-55. [Medline].
- Borucki R, Perry DM, Lopez-Garcia DR, Kazlouskaya V, Elston DM. Fluorescence microscopy for the evaluation of elastic tissue patterns within fibrous proliferations of the skin on hematoxylin-eosin-stained slides. J Am Acad Dermatol. 2018 Jan 5. [Medline].
- Kim HJ, Lee JY, Kim SH, et al. Stromelysin-3 expression in the differential diagnosis of dermatofibroma and dermatofibrosarcoma protuberans: comparison with factor XIIIa and CD34. Br J Dermatol. 2007 Aug. 157(2):319-24. [Medline].
- Maekawa T, Jinnin M, Ihn H. The expression levels of thrombospondin-1 in dermatofibroma and dermatofibrosarcoma protuberans. Eur J Dermatol. 2011 Jul-Aug. 21(4):534-8. [Medline].
- Li J, Yu Y, Yang Y, Wang L, Cao J, Liang X, et al. IGFBP7, a novel immunohistochemical marker in differentiating dermatofibroma from dermatofibrosarcoma protuberans. J Eur Acad Dermatol Venereol. 2012 Mar. 26(3):382-5. [Medline].
- Mori T, Misago N, Yamamoto O, Toda S, Narisawa Y. Expression of nestin in dermatofibrosarcoma protuberans in comparison to dermatofibroma. J Dermatol. 2008 Jul. 35(7):419-25. [Medline].
- Karanian M, Pérot G, Coindre JM, Chibon F, Pedeutour F, Neuville A. Fluorescence in situ hybridization analysis is a helpful test for the diagnosis of dermatofibrosarcoma protuberans. Mod Pathol. 2015 Feb. 28 (2):230-7. [Medline].
- Zelger BG, Zelger B. [Dermatofibroma. A clinico-pathologic classification scheme]. Pathologe. 1998 Nov. 19(6):412-9. [Medline].
- Fuciarelli K, Cohen PR. Sebaceous hyperplasia: a clue to the diagnosis of dermatofibroma. J Am Acad Dermatol. 2001 Jan. 44(1):94-5. [Medline].
- Spaun E, Zelger B. Dermatofibroma with intracytoplasmic eosinophilic globules: an unusual phenomenon. J Cutan Pathol. 2009 Jul. 36(7):796-8. [Medline].
- Garrido-Ruiz MC, Carrillo R, Enguita AB, Peralto JL. Signet-ring cell dermatofibroma. Am J Dermatopathol. 2009 Feb. 31(1):84-7. [Medline].
- Quigley BC, Ricciuti J, Morgan MB. Amyloid Light Chain Deposition Associated with Dermatofibroma: Serendipity or Association?. Am J Dermatopathol. 2010 Jan 23. [Medline].
- Yamamoto T. Incidental acantholysis of the overlying epidermis of dermatofibroma. J Eur Acad Dermatol Venereol. 2009 Jun. 23(6):735-6. [Medline].
- Zeidi M, North JP. Sebaceous induction in dermatofibroma: a common feature of dermatofibromas on the shoulder. J Cutan Pathol. 2015 Jun. 42 (6):400-5. [Medline].
- King R, Googe PB, Page RN, Mihm MC Jr. Melanocytic lesions associated with dermatofibromas: a spectrum of lesions ranging from junctional nevus to malignant melanoma in situ. Mod Pathol. 2005 Aug. 18(8):1043-7. [Medline].
- Shin J, Vincent JG, Cuda JD, Xu H, Kang S, Kim J, et al. Sox10 is expressed in primary melanocytic neoplasms of various histologies but not in fibrohistiocytic proliferations and histiocytoses. J Am Acad Dermatol. 2012 Oct. 67(4):717-26. [Medline].
- Kovach BT, Boyd AS. Melanoma associated with a dermatofibroma. J Cutan Pathol. 2007 May. 34(5):420-2. [Medline].
- Kim HJ, Kim IH. A 3-mm margin completely removes dermatofibromas: a study of 151 cases. Dermatol Surg. 2015 Feb. 41 (2):283-6. [Medline].
- Weber PJ, Moody BR, Foster JA. Inverted pyramidal biopsy. Dermatol Surg. 2001 Jul. 27(7):681-4. [Medline].
- Krupa Shankar DS, Kushalappa AA, Suma KS, Pai SA. Multiple dermatofibromas on face treated with carbon dioxide laser. Indian J Dermatol Venereol Leprol. 2007 May-Jun. 73(3):194-5. [Medline].
- Alonso-Castro L, Boixeda P, Segura-Palacios JM, de Daniel-Rodríguez C, Jiménez-Gómez N, Ballester-Martínez A. Dermatofibromas treated with pulsed dye laser: Clinical and dermoscopic outcomes. J Cosmet Laser Ther. 2012 Apr. 14(2):98-101. [Medline].